Comment le système de récompense module les réactions de peur?
Le stress est un moteur essentiel de l’adaptation et la réponse au stress d’un organisme est généralement bénéfique car elle favorise la survie. En cas de danger, le cerveau orchestre la détection et la réponse aux stimuli aversifs environnementaux et guide ainsi la sélection de la stratégie d’adaptation la plus appropriée parmi un répertoire diversifié de comportements défensifs. Ces comportements innés et acquis ont été façonnés par la sélection naturelle et conservés à la fois chez les invertébrés et les vertébrés. Ils comprennent des stratégies passives telles que le « freezing » (ou immobilité) et des réponses actives « fight or flight » (combat ou fuite), et le passage entre ces modes passifs/actifs est essentiel pour la flexibilité comportementale. Le freezing est une réponse universelle à la peur caractérisée par une absence totale de mouvement, à part la respiration, due à une posture corporelle tendue lorsqu’une menace est rencontrée. Le freezing est essentiel dans les processus de gestion du stress, car il correspond à un état d’hypervigilance qui permet de prendre des décisions et, par conséquent, d’élaborer la stratégie comportementale la plus pertinente. Bien que le freezing soit pertinent pour l’étiologie des troubles liés à la peur tels que les troubles de stress post-traumatique, les attaques de panique et les phobies sociales, les circuits neuronaux et les substrats cellulaires sous-jacents sont loin d’être bien compris.
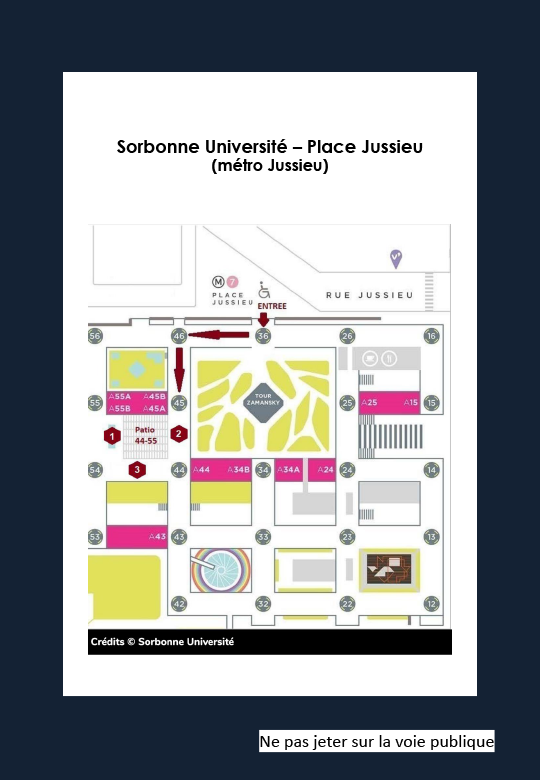
Pour aborder cette question, nous avons combiné des approches par électrophysiologie ex vivo et in vivo couplées à des outils de pharmaco- et optogénétiques complétées par des analyses par microscopie. Nous avons utilisé un modèle préclinique d’exposition à un stimulus aversif et mesurer les réponses immédiates de freezing. Nous avons mis en évidence de nouvelles structures clefs modulant ce comportement de défense. Ces structures cérébrales relient les neurones GABAergiques du tegmentum latéro-dorsal (LDTg) qui projettent vers l’aire tegmentale ventrale (ATV), une structure bien connue pour son rôle dans les réponses liées à la récompense. Au sein de l’ATV, ce sont également les neurones GABAergiques de projection qui transmettent ensuite cette information à l’amygdale cérébrale. L’activation du triumvirat LDTg-ATV-Amygdale par des événements aversifs permet de mieux comprendre les processus cérébraux d’adaptation au stress. Ces résultats remettent notamment en question la vision acceptée de l’axe LDTg-ATV qui a été historiquement lié à la récompense et aux processus de renforcement.
Référence :
A non-canonical GABAergic pathway to the VTA promotes unconditioned freezing
Loïc Broussot 1, 2*, Thomas Contesse 1, 2*, Renan Costa-Campos1, 2, Christelle Glangetas3, Léa Royon 1, 2, Hugo Fofo 1, 2, Thomas Lorivel 2, François Georges 3, Sebastian P. Fernandez 1, 2, 4 and Jacques Barik 1, 2, 4.
1 Université Côte d’Azur, Nice, France.
2 Institut de Pharmacologie Moléculaire & Cellulaire, CNRS UMR7275, Valbonne, France.
3 Université de Bordeaux, CNRS, IMN, UMR 5293, F-33000 Bordeaux, France.
4 Co-last and co-corresponding authors.
Légende de la figure :
Gauche : coupe coronale de cerveau contenant la région du noyau latérodorsal du tegmentum (LDTg) ; les neurones GABAergiques de cette structure sont identifiables grâce à l’expression restreinte de la protéine fluorescente mCherry. Centre : schéma d’un cerveau en 3D de souris permettant de visualiser le circuit neuronal (LDTg->VTA->Amygdale) identifié dans l’étude Broussot et al., mettant en évidence son rôle dans la modulation du comportement de freezing chez l’animal vigile (droite).
Contact :
Jacques Barik
Maitre de Conférences, Université Côte d’Azur
barik@ipmc.cnrs.fr
04 93 95 34 43
Institut de Pharmacologie Moléculaire et Cellulaire
CNRS – Univesité Côte d’Azur.
660 route des Lucioles
06560 Sophia Antipolis, Valbonne
English Summary
Stress is a key motor of adaptation The stress response is mostly beneficial as it promotes survival. In the event of danger, the brain orchestrates the detection of and response to aversive environmental stimuli and thus guides the selection of the most appropriate coping strategy from a diverse repertoire of defensive behaviours. These innate and acquired behaviours have been shaped by natural selection and conserved in both invertebrates and vertebrates. They include passive strategies such as freezing and active ‘fight or flight’ responses, and switching between these passive/active modes is essential for behavioural flexibility. Freezing is a universal fear response characterised by a complete absence of movement, apart from breathing, due to tense body posture when a threat is encountered. Freezing is essential in stress management processes, as it corresponds to a state of hypervigilance that allows for decision making and, consequently, the development of the most appropriate behavioural strategy. Although freezing is relevant to the etiology of fear-related disorders such as post-traumatic stress disorder, panic attacks and social phobias, the underlying neural circuitry and cellular substrates are far from being well understood.
To address this issue, we combined ex vivo and in vivo electrophysiology approaches coupled with pharmaco- and optogenetic tools complemented by microscopy analyses. We used a preclinical model of exposure to an aversive stimulus and measured the immediate freezing responses. We identified new key structures modulating this defensive behaviour. These brain structures connect GABAergic neurons in the lateral-dorsal tegmentum (LDTg) that project to the ventral tegmental area (VTA), a structure well known for its role in reward-related responses. Within the VTA, it is also the GABAergic projection neurons that then transmit this information to the amygdala. The activation of the LDTg-ATV-Amygdala triumvirate by aversive events provides a better understanding of the brain’s processes of adaptation to stress. In particular, these results challenge the accepted view of the LDTg-ATV axis, which has historically been linked to reward and reinforcement processes.
FORMATION DE LA MEMOIRE SOCIALE : PLASTICITES EN CASCADE DANS L’HIPPOCAMPE
La cognition sociale est une fonction importante pour de nombreuses espèces qui est altérée lors de maladies psychiatriques et neurodégénératives. Bien que l’hippocampe et en particulier la région CA2 soient connus pour jouer un rôle clé dans la formation de mémoire sociale, les mécanismes cellulaires impliqués ne sont pas connus.
Dans une étude récente réalisée sur des souris, nous décrivons comment deux plasticités synaptiques de la transmission inhibitrice dans CA2 pourraient être déclenchées afin de coder l’identité d’une nouvelle souris et d’en former une mémoire à long-terme.
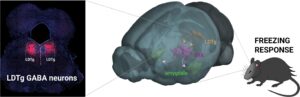
Plus précisément, nous montrons comment l’exposition d’une souris à un nouvel individu induit tout d’abord une dépression à long-terme de la transmission inhibitrice des interneurones exprimant la parvalbumine par l’intermédiaire de récepteurs delta-opioïdes. La diminution de la transmission inhibitrice permet ensuite aux neurones principaux de CA2 de générer des potentiels d’actions et d’induire une deuxième dépression à long-terme de la transmission inhibitrice par l’activation des récepteurs cannabinoides de type I (CB1) sur les interneurones exprimant la cholécystokinine. Le blocage des récepteurs CB1 dans la région CA2 empêche complètement la formation de mémoire sociale. Par ailleurs, la plasticité dépendante des récepteurs CB1 est fortement diminuée sur un modèle murin de schizophrénie, qui a aussi un fort déficit de mémoire sociale. Enfin, une manipulation pharmacologique de l’excitabilité des neurones principaux de CA2, qui était connue pour améliorer la mémoire sociale sur ces souris, restaure aussi la plasticité induite par les récepteurs CB1.
Ces résultats montrent l’importance de l’interaction entre deux plasticités inhibitrices dans la formation de mémoire sociale et offrent de nouvelles perspectives de traitement dans des pathologies avec altération de la cognition sociale.
Légende de la figure:
En condition basale, la transmission synaptique entre les neurones pyramidaux CA3 et CA2 est dominée par une importante inhibition de type ‘feed-forward’ empêchant les neurones pyramidaux de CA2 de déclencher des potentiels d’action (PA). Lorsqu’une souris est exposée à une nouvelle souris, une dépression à long terme de la transmission inhibitrice des interneurones exprimant la parvalbumine (PV-IN) est induite par l’activation des récepteurs Delta-opioïdes (DOR-iLTD). Cette désinhibition permet aux PN de CA2 de générer des PA en réponse à l’activation des entrées de CA3. Après une exposition ultérieure à la nouvelle souris, les PN qui déclenchent suffisamment de PA expriment une deuxième iLTD médiée par l’activation des récepteurs cannabinoïdes de type I (CB1R-iLTD), ce qui augmente encore le déclenchement de PA dans ces PN.
Réference :
Sequential inhibitory plasticities in hippocampal area CA2 and social memory formation.
Loisy M, Bouisset G, Lopez S, Muller M, Spitsyn A, Duval J, Piskorowski RA, Verret L, Chevaleyre V. Neuron. 2022; 110(17):2854-66 doi: 10.1016/j.neuron.2022.06.013.
Contacts :
Vivien Chevaleyre / Rebecca Piskorowski: Université Paris Cité, INSERM U1266, Institute of Psychiatry and Neuroscience of Paris, 75014 Paris, France
Laure Verret: Research Center on Animal Cognition, Center for Integrative Biology, Toulouse University, CNRS, UPS, 31062 Toulouse, France
English summary:
Social cognition is a key function for numerous species and is altered during several psychiatric and neurodegenerative diseases. While the hippocampus and in particular area CA2 are known to play a critical role in social memory formation, the underlying cellular mechanisms are not known.
In a recent study performed in mice, we describe how two synaptic plasticities of inhibitory transmission could be induced during the coding of a novel mouse and the formation of a lasting memory.
More precisely, we show how exposure to a novel mouse induces a long-term depression of inhibitory transmission form parvalbumin-expressing interneuron via activation of delta-opioid receptors. The resulting dis-inhibition allows principal cells in CA2 to fire action potentials and to evoke a second long-term depression of inhibition from cholecystokinin-expressing interneurons through activation of cannabinoid type I receptors (CB1). Blockade of CB1 receptors in area CA2 completely prevents social memory formation. Furthermore, CB1-mediated plasticity is strongly reduced in a mouse model of schizophrenia with impaired social memory. Finally, pharmacological manipulation known to improve social memory in these mice also restores CB1-mediated plasticity.
These results highlight how interaction between two inhibitory plasticities plays an important role in social memory formation and reveal new therapeutic targets for pathologies with social cognition impairments.
Figure Legend :
In basal condition, synaptic drive between CA3 and CA2 pyramidal neurons (PN) is dominated by a large feed-forward inhibition preventing CA2 PNs to fire action potentials (AP). When a mouse is exposed to a novel mouse, a long-term depression of inhibitory transmission from parvalbumin-expressing interneurons (PV-IN) is induced by activation of Delta-opioid receptors (DOR-iLTD). This disinhibition allows CA2 PNs to fire APs in response to CA3 inputs activation. Following subsequent exposure to the novel mouse, PNs that fire enough APs express a second iLTD mediated by activation of cannabinoid type I receptors (CB1R-iLTD), hence further increasing AP firing in these PNs.
UNE NOUVELLE BOITE A OUTIL POUR EXPLORER LA DYNAMIQUE DES RECEPTEURS DANS LE CERVEAU
Les progrès sur la compréhension du fonctionnement du cerveau sont intrinsèquement liés aux progrès des méthodes d’investigation. La dynamique des récepteurs de neurotransmetteurs joue un rôle déterminant dans le fonctionnement des synapses et nécessite de nouvelles approches pour être étudiée au niveau de tissus cérébraux intacts. Nous rapportons dans Science Advances le développement d’une boite à outil complète depuis un nouveau modèle animal et un instrument d’imagerie jusqu’aux techniques de marquage et de contrôle de la dynamique des récepteurs qui permet de marquer par fluorescence et manipuler le mouvement des récepteurs dans le cerveau.
Les récepteurs de neurotransmetteurs sont concentrés dans les synapses en face des zones de libération du neurotransmetteur. C’est ce qui permet une transmission synaptique rapide et fidèle. Depuis 20 ans, notre laboratoire en premier en collaboration avec celui d’Antoine Triller, puis de nombreux autres, ont établis que ces récepteurs ne sont en fait pas immobiles dans les synapses mais sont en fait en grande partie très mobiles et échangent en permanence entre les zones synaptiques et extrasynaptiques par diffusion aléatoire (brownienne). C’est un savant équilibre entre cette mobilité et la stabilisation réversible des récepteurs aux synapse par interaction avec des protéines d’échafaudage qui détermine le nombre de récepteurs à la synapse, et détermine ainsi l’efficacité de la transmission synaptique. De plus, de nombreux travaux menés par notre laboratoire et d’autres ont permis de dévoiler l’extrême régulation à laquelle sont soumise ces processus et leurs rôles déterminant dans divers processus physiopathologiques. Nous avons par exemple récemment établi que la diffusion-stabilisation des récepteurs du neurotransmetteur glutamate de type AMPA est indispensable pour la potentiation des synapses glutamatergiques en réponse à une forte activité synaptique. Ce processus, appelé potentialisation à long terme, semble être un des substrat cellulaire majeur des phénomène de mémoire et d’apprentissage. En support de cet hypothèse, nous avons d’ailleurs établi que le blocage de la mobilité des récepteurs empêche la formation de certaines formes de mémoire. Dans un autre registre, une mobilité anormale des récepteurs semble être impliquée dans les déficits mnésiques observés dans différentes pathologies telles que les maladies d’Alzheimer ou de Huntington.
Il est donc très important de pouvoir étudier ces processus de mobilité des récepteurs et les contrôler, dans un contexte aussi proche de la réalité physiologique. Cependant, les techniques d’imagerie et les outils moléculaires nécessaires pour l’étude de ces phénomènes de mobilité sont depuis longtemps restés essentiellement limités à des systèmes expérimentaux réducteurs que sont les cultures dissociées de neurones. Ces systèmes, même s’ils présentent un intérêt certain, ne reproduisent pas l’intégralité de la complexité d’un tissus nerveux, manquant en particulier de reproduire l’environnement cellulaire et la connectivité du cerveau intact.
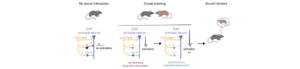
Dans le travail publié dans Science Advances, nous avons développé un nouveau modèle de souris génétiquement modifiée et une panoplie d’outils moléculaire et un instrument d’imagerie qui nous permettent maintenant de dépasser cette limite et mesurer et manipuler la mobilité des récepteurs dans le tissus cérébral intact, jusqu’à in vivo. En utilisant le modèle des récepteurs AMPA du glutamate, qui sont sous-jacents à la transmission excitatrice dans le cerveau, nous avons utilisé une technique d’étiquetage de la sous-unité GluA2 de ces récepteur avec une séquence peptidique qui permet l’ajout un résidu biotine en présence de l’enzyme biotine ligase. Dans le modèle de souris que nous avons développé, toutes les sous-unités GluA2 sont étiquetées, mais sont uniquement biotinylée dans les neurones dans lesquels nous exprimons la biotine ligase. La puissance de cette méthode permet de réaliser un marquage spécifique des récepteurs dans des populations de neurones déterminées. Ce marquage spécifique nous donne d’une part accès à l’utilisation de techniques d’imagerie à haute résolution dans les tissus, et d’autre part nous permet de contrôler la mobilité des récepteurs à l’aide de ligands multivalents de la biotine. Nous présentons de ce point de vue le développement d’une nette amélioration de la technologie d’imagerie par feuille de lumière, qui permet de mesurer la mobilité des récepteurs endogènes dans des tranches de cerveau. Nous appliquons cet ensemble de technologies pour établir que les récepteurs de types AMPA endogènes sont bien mobiles dans le tissus cérébral, ainsi que nous l’avions prédit à partir de nos travaux sur cellules en culture, et que cette mobilité est indispensable pour la potentialisation à long terme et certaines formes de mémoire conditionnelle. Ce nouveau modèle expérimental et cette boite à outil va nous permettre d’une part d’explorer les propriétés et le rôle de la mobilité des récepteurs AMPA et pourra d’autre part être appliquée à tout un ensemble d’autres protéines membranaires tels que d’autres types de récepteurs, canaux ioniques ou des protéines d’adhésion.
Figure: Un modèle de souris transgénique permet la biotinylation enzymatique spécifique des sous-unités endogènes des récepteurs du glutamate. Leur mobilité à la membrane plasmique peut être mesurée ou contrôlée dans le tissu cérébral à l’aide de protéines fluorescentes de liaison à la biotine. La réticulation de ces protéines permet un contrôle spécifique de la plasticité synaptique et du comportement des animaux.
English summary:
Advances in understanding how the brain works are intrinsically linked to advances in experimental methods. Neurotransmitter receptor dynamics play a key role in tuning synapse function and require new approaches to be studied at the level of intact brain tissue. In Science Advances, we report the development of a complete toolkit, from a new animal model and imaging instrumentation to molecular techniques for labeling and controlling the dynamics of receptors, that allow fluorescent labeling and manipulation of the movement of endogenous glutamate receptors in the brain.
Figure: A biotin acceptor peptide tag (AP tag) knock-in mouse model allows target-specific enzymatic biotinylation of endogenous glutamate receptor subunits. Their surface diffusion dynamics can be measured or controlled in brain tissue using fluorescent biotin binding proteins (BBP). Crosslinking with BBP allows for target-specific control of synaptic plasticity and animal behavior.
Contact chercheurs
Directeur de recherche au CNRS
Institut Interdisciplinaire de Neurosciences et Bordeaux Imaging Center
146 rue Léo Saignat, 33076 Bordeaux Cedex
Directeur de recherche au CNRS
Institut Interdisciplinaire de Neurosciences
146 rue Léo Saignat, 33076 Bordeaux Cedex
COMPRENDRE LES PLEURS D’UN BEBE N’EST PAS INNÉ !

Quel parent ne s’est pas demandé ce que disent les pleurs de son bébé ? Alors que l’on fait habituellement confiance à un soi-disant « instinct parental » pour comprendre bébé, une étude démontre que s’être déjà occupé de bébés est pourtant indispensable pour interpréter correctement leurs pleurs. Ce résultat témoigne combien l’expérience façonne notre capacité à décoder les informations véhiculées par les signaux de communication des bébés, et de l’importance de s’entraîner pour parvenir à les comprendre. Cette étude, qui vient d’être publiée dans Current Biology, a été menée par des scientifiques de l’Université de Saint-Etienne et de l’Institut universitaire de France.
« Nous avons constaté que la capacité à détecter la douleur exprimée dans les pleurs est modulée par l’expérience que l’on a des bébés », déclare Nicolas Mathevon. « Les parents s’occupant actuellement de jeunes bébés sont ainsi capables d’identifier les pleurs de douleur d’un bébé même s’ils n’ont jamais entendu ce bébé auparavant, alors que des personnes n’ayant aucune expérience préalable des bébés en sont généralement incapables. »
Nicolas Mathevon et ses collègues de l’Université de Saint-Étienne (Siloé Corvin, Camille Fauchon, Roland Peyron et David Reby) ont fait cette découverte dans le cadre d’un programme de recherche visant à déterminer comment les informations sont encodées dans les pleurs des bébés et comment les adultes les extraient. Dans cette étude, ils ont voulu déterminer comment une expérience préalable des bébés influe sur la capacité à identifier les moments où ils souffrent.
Ils ont recruté des personnes ayant une expérience variable des bébés, depuis des personnes sans aucune expérience jusqu’à des parents de jeunes bébés. Ils ont également inclus des personnes ayant une expérience occasionnelle du baby-sitting et des non-parents ayant une expérience professionnelle de soins aux bébés.
Ensuite, ils ont organisé pour tous les participants et participantes une courte phase d’entraînement au cours de laquelle les gens entendaient huit pleurs d’inconfort d’un bébé donné. Ensuite, leur capacité à décoder les pleurs de ce même bébé et ceux d’un bébé inconnu comme étant des pleurs d’inconfort ou de douleur a été mise à l’épreuve.
L’expérience était déterminante : les personnes ayant peu ou pas d’expérience ont classé les pleurs au hasard, sans pouvoir identifier avec certitude lesquels signifiaient la douleur. Ceux qui avaient un peu d’expérience des bébés ont fait légèrement mieux. Les parents de grands enfants et les professionnels des bébés ont su identifier les pleurs d’inconfort et de douleur du bébé avec lequel ils avaient été entrainé. Les grands gagnants ont été les parents de jeunes bébés : ils ont été capables d’identifier les pleurs des bébés connus comme inconnus !
Les résultats montrent que les pleurs des bébés contiennent des informations importantes qui sont codées dans leur structure acoustique. Si les adultes sont sensibles à ces informations, notre capacité à les décoder et à identifier la douleur d’un bébé s’améliore avec l’exposition et l’expérience.
Les scientifiques espèrent que le fait d’en savoir plus sur la façon dont les bébés communiquent la douleur pourra aider les parents à apprendre à la reconnaître et à y répondre encore mieux. Ils mènent actuellement des études de neuro-imagerie afin d’explorer plus avant la manière dont l’expérience et la parentalité influencent l’activité cérébrale lorsque les bébés pleurent.
English summary: Deciphering a Babies Cries of Discomfort vs. Pain Comes with Experience
Every parent has wondered what their crying baby is saying. While we usually rely on a so-called « parenting instinct » to understand our babies, a study shows that having cared for babies is a prerequisite for correctly interpreting their cries. The result shows how experience shapes our ability to decode the information conveyed by babies’ communication signals, and how important it is to train to understand them. This study, which has just been published in Current Biology, was conducted by scientists from the University of Saint-Etienne and the Institut Universitaire de France.
“We found that the ability to detect pain in cries—that is, to identify a pain cry from a mere discomfort cry—is modulated by experience of caring for babies,” said Nicolas Mathevon. “Current parents of young babies can identify a baby’s pain cries even if they have never heard this baby before, whereas inexperienced individuals are typically unable to do so.”
The findings show that human’s ability to interpret babies’ cries isn’t innate but learned from experience. Parenting young babies shapes our ability to decode the information conveyed by babies’ communication signals.
Mathevon and his University of Saint-Etienne colleagues (Siloé Corvin, Camille Fauchon, Roland Peyron and David Reby) made this discovery as part of a broader research program investigating how information is encoded in babies’ cries and how human listeners extract this information. In the new study, they wanted to find out how prior caregiving experience with babies shaped the ability to identify when they were in pain.
They recruited people with different amounts of experience caring for babies, ranging from people with no experience at all to current parents of young children. They also included people with occasional experience babysitting and non-parents with more extensive professional experience in caregiving. Next, they gave everyone in the study a short training phase in which they heard eight discomfort cries from one baby over a couple of days. Next, their ability to decode the cries as discomfort or pain was put to the test.
And it turned out that experience was everything. People with little to no experience couldn’t tell the difference between cries any better than chance. Those with a small amount of experience performed slightly better. Current parents and professionals did better than chance. But parents of younger babies were the clear winners. They were able to identify the crying contexts of babies even when they’d never heard the cries of that youngster before. Parents of older kids and those with professional experience didn’t do well with unfamiliar cries.
The findings show that babies’ cries contain important information that’s encoded in their acoustic structure. While adults are attuned to that information, our ability to decode it and identify when a baby is in pain, gets better with exposure and experience.
The researchers hope that learning more about how babies communicate pain may help parents learn how to recognize and respond to it even better. They’re now conducting neuroimaging studies to further explore how experience and parenthood shape brain activity when babies cry.
References
Corvin S, Fauchon C, Peyron R, Reby D, Mathevon N, 2022. Adults learn to identify pain in babies’ cries. Current Biology, 32:R807-R827.
Other publications from the Baby cry project:
Bouchet H, Plat A, Levrero F, Reby D, Patural H, Mathevon N, 2020. Baby cry recognition is independent of motherhood but improved by experience and exposure. Proceedings Royal Society London B, 287:20192499.
Levréro F, Mathevon N, Pisanski K, Gustafsson E, Reby D, 2018. The pitch of babies’ cries predicts their voice pitch at age five. Biology Letters, 14:20180065.
Koutseff A, Reby D, Martin O, Levréro F, Patural H, Mathevon N, 2018. The acoustic space of pain: Cries as indicators of distress recovering dynamics in preverbal infants. Bioacoustics, 27:313-325.
Reby D, Levréro F, Gustafsson E, Mathevon N, 2016. Sex stereotypes influence adults’ perception of babies’ cries. BMC Psychology, 4:19.
Gustafsson E, Levrero F, Reby D, Mathevon N, 2013. Fathers are just as good as mothers at recognizing the cries of their baby. Nature Communications 4:1698.
Contact :
ENES Bioacoustics Research Laboratory
Centre de Recherche en Neurosciences de Lyon
CNRS UMR 5292, Inserm UMR_S 1028
Université de Saint-Etienne
23 rue Michelon
42023 Saint-Etienne cedex 2
Les Synapses Pivot à Dopamine dans le striatum : un nouveau point névralgique pour la neuromodulation par la dopamine ?
Comment s’organise la conversation entre les neurones dans le cerveau ? Au travers de 2 articles récents nous décrivons une partie de cette organisation aux synapses entre les neurones à dopamine et les neurones environnants. Les synapses, points de contact entre les neurones, sont fondamentale pour le bon fonctionnement du cerveau. On peut distinguer deux grands types de neurones. Les neurones effecteurs assurent une transmission rapide et locale de l’information soit excitatrice soit inhibitrice, tandis que les neurones modulateurs, peu nombreux, affectent de grandes régions du cerveau sur de plus longues durées. Les neurones modulateurs utilisant la dopamine sont très importants pour la régulation du contrôle moteur, de la motivation et de la perception d’une récompense.
Dans nos études, nous avons établi la première purification sélective des synapses dopaminergiques du striatum qui nous a permis d’identifier 2650 protéines, dont 57 spécifiquement enrichies. En revanche, peu d’ARN messagers (codant les protéines) sont sélectivement détectés, suggérant que la traduction locale des protéines n’est pas un mécanisme majeur au niveau des axones des neurones dopaminergiques. De plus, nous avons identifié une nouvelle structure où les synapses dopaminergiques interagissent physiquement avec d’autres synapses classiques et affectent la composition de ces dernières. Ces « Synapses Pivot à Dopamine » pourraient constituer un support important de la neuromodulation par la dopamine sur les circuits neuronaux du striatum, alimentant le débat entre modèles volumiques et synaptiques de la transmission modulatrice. Dans ce nouveau cadre conceptuel, les recherches futures permettront de comprendre en détail les mécanismes cellulaires par lesquels la dopamine module les mouvements volontaires ou l’apprentissage basé sur la prédiction de la récompense. Ceci est d’autant plus crucial que de nombreuses pathologies telles que la maladie de Parkinson, l’addiction et la schizophrénie semblent directement liées à une dysfonction dopaminergique.
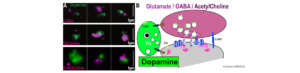
Figure : Synapses Pivot à dopamine isolées par tri activé par fluorescence. A : terminaisons synaptiques dopaminergiques isolées (vert) liées à des terminaisons positives pour le GABA (haut, magenta), le glutamate (milieu, magenta) ou l’acétylcholine (bas, magenta). Barre d’échelle 1µm. B : Exemple de synaptosome pivot à dopamine visualisé par microscopie électronique C : Modèle cartographique des synapses du hub de la dopamine. DR/D2R : Récepteurs de la Dopamine ; CAM : Molécule d’Adhésion Cellulaire : Th : Tyrosine hydroxylase (biosynthèse de la dopamine).
English summary: Dopamine Hub Synapses in the striatum: a new hot spot for dopamine transmission?
How is the conversation between neurons organized in the brain? Through 2 recent articles we describe part of this organization between the dopamine and surrounding neurons at synapses. Synapses are points of contact between neurons, essential for the proper functioning of the brain. In the brain, neurons are of 2 main types. The effector neurons ensure a rapid and local transmission of information, either excitatory or inhibitory, while the modulatory neurons, few in number, affect large regions of the brain over longer periods of time. Modulatory neurons using dopamine are very important for the tuning of motor control, motivation and reward perception.
In our studies, we established the first selective purification of dopaminergic synapses in the striatum that allowed us to identify 2650 proteins, 57 of which were specifically enriched. In contrast, few messenger RNAs (encoding proteins) are selectively detected, suggesting that local translation of proteins is not a major mechanism at the axons of dopaminergic neurons. In addition, we have identified a new structure where dopaminergic synapses physically interact with other classical synapses and affect the composition of the latter. These « Dopamine Hub Synapses » may mediate dopamine neuromodulation on striatal neuronal circuits, fueling the debate between volume and synaptic models of modulatory transmission. Within this new conceptual framework, future research will provide a detailed understanding of the cellular mechanisms by which dopamine modulates voluntary movements or reward-prediction based learning. This is crucial as many pathologies such as Parkinson’s disease, addiction and schizophrenia are linked to dopamine dysfunction.
Figure : Dopamine hub synapses isolated by fluorescence activated sorting. A: Isolated dopamine synaptic terminals (green) bind to GABA (top, magenta), Glutamate (middle, magenta) or Acetylcholine (bottom, magenta) positive terminals. Scale bar 1µm. B: Example of dopamine hub synaptosome observed at the electron microscope. C: Model cartoon of dopamine hub synapses. DR/D2R : Dopamine Receptors; CAM: Cell Adhesion Molecule: Th: Tyrosine hydroxylase (dopamine biosynthesis).
Références :
Paget-Blanc, V., Pfeffer, M.E., Pronot, M. et al. A synaptomic analysis reveals dopamine hub synapses in the mouse striatum. Nat Commun 13, 3102 (2022). https://doi.org/10.1038/s41467-022-30776-9
Hobson, BD., et al. Subcellular and regional localization of mRNA translation in midbrain dopamine neurons. Cell Reports, 38-2, (2022) https://doi.org/10.1016/j.celrep.2021.110208.
Contact :
Etienne Herzog
CNRS CRCN
Team Membrane Traffic at Synapses
Université de Bordeaux
Interdisciplinary Institute for NeuroScience – UMR 5297
Centre Broca Nouvelle-Aquitaine
146 rue Léo Saignat
CS 61292 Case 130
33076 Bordeaux Cedex (FRANCE)
Phone: +33 (0) 5 33 51 47 79
Caféine : ses effets moléculaires décryptés dans le cerveau
Des chercheurs de l’Inserm/Université et CHU de Lille et du CNRS/Université de Strasbourg décryptent les mécanismes moléculaires qui sous-tendent les effets de la caféine dans le cerveau. Ces travaux, réalisés chez la souris et publiés dans la revue The Journal of Clinical Investigation, renforcent l’idée d’un effet bénéfique de la caféine sur les fonctions cognitives.
La caféine est la substance psychoactive la plus consommée au monde. Alors que ses effets sur la vigilance et l’attention sont largement connus, les mécanisme moléculaires cérébraux associés à sa consommation régulière demeuraient peu connus jusqu’à présent. Le Dr. David Blum du laboratoire « Alzheimer & Tauopathies » du centre de recherche Lille Neuroscience & Cognition (Inserm/Université Lille/CHU de Lille) en collaboration avec le Dr. Anne-Laurence Boutillier du laboratoire de neurosciences cognitives et adaptatives (CNRS/Université de Strasbourg) vient de démontrer, chez la souris, qu’une consommation habituelle de caféine induit des changements moléculaires durables dans l’hippocampe, une structure essentielle à la mémoire et qui dégénère dans la maladie d’Alzheimer. Les résultats montrent notamment que la caféine modifie de manière très importante l’épigénome hippocampique de manière différenciée selon qu’il s’agisse des cellules neuronales ou non-neuronales. Cela concourrait à favoriser le traitement de l’information en réponse à une tache d’apprentissage, en exerçant une action concertée sur les cellules neuronales et non-neuronales.
Cette étude fait écho aux travaux précédents du laboratoire Alzheimer & Tauopathies suggérant un impact bénéfique de cette molécule dans le contexte de la maladie d’Alzheimer et à l’essai clinique de phase III en cours (CAFCA).
English summary
Caffeine is the most widely consumed psychoactive drug. However, there is a striking mismatch between the epidemiological evidence associating the regular intake of caffeine with benefits for chronic brain disorders and the molecular clarification of the impact of caffeine on brain function. Herein, using a combination of different non-hypothesis driven-omic approaches, we show that, in the bulk tissue analysis, chronic caffeine treatment reduced metabolic processes related to lipids, mitochondria and translation in the mouse hippocampus, some of which were identified at the different molecular levels analyzed, i.e. epigenome, transcriptome, proteome and metabolome. In sharp contrast to what was observed in bulk tissue, we found that caffeine induced a neuronal autonomous epigenomic response related to synaptic plasticity activation. These data were corroborated by the fact that caffeine treatment induced an increase in glutamatergic synapse proteins in the hippocampus and ultimately, enhanced transcriptomic regulations in response to learning. Overall, our data prompt the novel concept that regular caffeine intake promotes a more efficient ability of the brain to encode experience-related events. By coordinating epigenomic changes in neuronal and non-neuronal cells, regular caffeine intake promotes a fine-tuning of metabolism in resting conditions, likely improving neuronal activity in response to learning.
Source
Paiva I, Cellai L, Meriaux C, Poncelet L, Nebie O, Saliou JM, Lacoste AS, Papegaey A, Drobecq H, Le Gras S, Schneider M, Malik EM, Müller CE, Faivre E, Carvalho K, Gomez-Murcia V, Vieau D, Thiroux B, Eddarkaoui S, Lebouvier T, Schueller E, Tzeplaeff L, Grgurina I, Seguin J, Stauber J, Lopes LV, Buée L, Buée-Scherrer V, Cunha RA, Ait-Belkacem R, Sergeant N, Annicotte JS, Boutillier AL, Blum D (2022) Caffeine intake exerts dual genome-wide effects on hippocampal metabolism and learning-dependent transcription. The Journal of Clinical Investigation. https://doi.org/10.1172/JCI149371
Contact chercheurs
David Blum
Directeur de recherche Inserm
Lille Neuroscience & Cognition
UMR-S 1172 (Inserm/ Univ. Lille/CHU Lille)
Equipe « Alzheimer & Tauopathies » – LabEx DISTALZ
Tél : 06 50 82 04 90
Anne-Laurence Boutillier
Directrice de recherche Cnrs
UMR7364 (Cnrs/université de Strasbourg)
Equipe « Epigenetics & Memory dynamics »
Tél : 03 68 85 19 34
Le Cerveau en Musique – Conférence grand public et concert

Dans le cadre de la Fête de la musique et du FENS Forum 2022, la conférence grand public le Cerveau en Musique,
suivie d’un concert de Membrane Band, aura lieu dans le grand auditorium de Sorbonne Université à Jussieu,
le 21 juin 2022
Nous vous y attendons nombreuses et nombreux à partir de 17h45 !
Nous soutenons nos collègues affectés par la guerre en Ukraine

To all neuroscientists whose life and work have been affected by the Ukraine war: we stand with you and offer support. Below are listed a number of infos & resources should you want to relocate to France :
Усім нейробіологам, чиє життя та діяльність постраждали від війни в Україні: ми з вами та підтримуємо.
Нижче наведено деяку інформацію та ресурси, якщо ви хочете переїхати у Францію:
Всем нейроучёным, на чью жизнь и работу повлияла война в Украине: мы с вами и предлагаем вам поддержку.
Ниже вы найдете информацию и ресурсы, которые помогут вам переехать во Францию:
English version (updated April 4, 2022)
Ukrainian version (updated April 4, 2022)
The Federation of European Neuroscience Societies (FENS) also lists information. See their website.
Pour les neuroscientifiques en France, voici ce que vous pouvez faire :
1) Faites savoir que vous êtes prêt·e·s à aider
– faites savoir que vous pourriez héberger un·e scientifique (chercheur.e, post-doc, étudiant.e) sur le site ScienceForUkraine
Vous pouvez soumettre votre annonce ici.
– la FENS permet de déposer des annonces ciblant les scientifiques d’Ukraine. Voir leur site web.
– une autre liste, très utilisée en Pologne, où vous pouvez vous faire connaître : formulaire pour soumettre une annonce ici.
2) Financer l’accueil d’un·e scientifique par le programme PAUSE
Informations sur le site web dédié.
En bref :
– il y a deux programmes :
• un programme spécifique pour les scientifiques arrivant d’Ukraine, avec une aide financière d’urgence de 3 mois, un dossier léger et une évaluation au fil de l’eau ;
• un programme pour tou·te·s les scientifiques en danger hors UE, avec un apport du programme PAUSE jusqu’à hauteur de 60% du salaire ; le dossier est un peu plus complet, avec 3 appels par an.
– Votre interlocuteur·trice est le ou la responsable des relations internationales de votre institution, qui vous aidera à monter le dossier et fera la liaison avec le programme PAUSE
3) Pensez à proposer la possibilité de travail à distance
De nombreux scientifiques et étudiant·e·s restent en Ukraine et sont à la recherche de possibilités de travail à distance, de contacts, de mentoring.
N’hésitez pas à proposer du travail à distance, si votre domaine s’y prête.
Vous pouvez poster les annonces pour du travail à distance sur Science for Ukraine.
Il existe aussi des sites dédiés notamment pour le mentoring, l’offre de cours en ligne, etc.. vous trouverez plus d’infos ici.
et là.
Actions du Fonds de dotation NeuroCitoyen

Message de la gouvernance du Fonds de dotation NeuroCitoyen à destination de la communauté des chercheur·e·s en neurosciences.
La place des neurosciences dans la société : à la croisée des mondes
Les Neurosciences occupent une place tout à fait particulière dans le domaine des disciplines scientifiques, pour au moins trois raisons principales :
- Elles ont la caractéristique unique d’être au croisement de différentes disciplines : biologie et médecine; mathématiques et physique; psychologie, linguistique et philosophie; intelligence artificielle et science des données, pour ne citer que les principales.
- Elles s’intéressent à l’organe le plus mystérieux des systèmes biologiques, le cerveau. En cela, elles s’attaquent, peut être avec l’astrophysique, à l’un des derniers remparts majeurs, de nos connaissances scientifiques.
- Elles ont, de par la mise en œuvre de leurs concepts et leurs domaines d’application, des retentissements éclairants sur la Société et nos concitoyen·ne·s, qui montrent, au travers de leur participation massive à la Semaine du Cerveau, notamment, un appétit considérable pour tout ce qui concerne la connaissance du cerveau et pas seulement en rapport avec les pathologies.
Les sociétés savantes et leur place dans la société
Les Sociétés savantes, dans leur ensemble -et la Société des Neurosciences n’y échappe pas-, souffrent de plus en plus d’un manque de soutien institutionnel alors qu’elles sont en particulier le creuset de la transmission de nos connaissances et de leur partage avec le grand public. Leur situation financière, dès lors, est devenue difficilement viable et s’est aggravée par les deux années difficiles que nous venons de traverser, du fait de l’annulation de la plupart des évènements où elles trouvaient, non seulement un nécessaire terrain d’échanges et de rencontres particulièrement profitables à nos jeunes en formation, mais aussi, il faut le reconnaître, quelques moyens pour les faire vivre et permettre à ces Sociétés de remplir leurs missions.
Le lancement du Fonds NeuroCitoyen, une initiative innovante
C’est dans ce contexte que la Société des Neurosciences a créé le Fonds de dotation NeuroCitoyen, permettant de faire appel au soutien et à la générosité du public, particuliers et entreprises, tout en autorisant la défiscalisation des dons à hauteur de 66% pour les particuliers et de 60% pour les entreprises.
Ce fonds, pionnier dans le domaine, a été pensé avec comme mission principale de promouvoir le partage des connaissances avec les citoyen·ne·s, par le biais de manifestations grand public et de rapports d’expertise, sur des sujets à forts enjeux stratégiques ou éthiques. Ses missions sont aussi de connecter la recherche et la formation des jeunes chercheur·e·s et d’accroitre les échanges de connaissance avec la clinique et le monde socio-économique.
Il devient, en particulier
- un support important de la Semaine du Cerveau, par le biais d’un appel à dons.
- un outil pour soutenir les jeunes chercheur·e·s
- un levier pour rapprocher la recherche du monde socio-économique
Il sera le promoteur d’initiatives innovantes pour rapprocher la société civile et la recherche dans le domaine des neurosciences.
Pourquoi nous rejoindre dans cette aventure inédite ?
Nous avons besoin de vos idées et partages pour assurer la pleine réussite de cette initiative inédite et pionnière !
En créant un lien direct entre les neuroscientifiques et les citoyen·ne·s, nous sommes convaincus que le fonds de dotation sera un instrument à la fois original mais surtout opportun, pour promouvoir un vrai dialogue symbiotique, riche d’échanges fructueux.
Votre aide est précieuse pour contribuer aux idées, lancer une initiative qui vous tient à cœur ou pour renforcer notre lien avec les acteur·trice·s de la société civile (particuliers et monde socio-économique).
Vous êtes intéressé·e·s ? Contactez-nous !
Comment nous aider à court terme ?
Partagez le lancement de ce fonds NeuroCitoyen auprès de vos ami·e·s, familles, contacts professionnels, vos réseaux !
- Manifestez-vous auprès de nous si vous avez la volonté de nous aider dans le cadre du lancement du fonds
- Identifiez des acteur·trice·s qui pourraient être nos partenaires « bâtisseurs » du Fonds NeuroCitoyen
- Relayez notre appel au don sur vos réseaux : tout le monde doit se sentir concerné dans un esprit de partage et de soutien à la Société des Neurosciences. Il n’y a pas de « petits dons », y compris « l’euro symbolique » qui sera le bienvenu !
- Guettez les réseaux sociaux, nous allons communiquer largement dans les semaines à venir.
Vous êtes intéressé·e·s ? Contactez-nous :
André Nieoullon, Président du CA du Fonds NeuroCitoyen, ancien Président de la Société des Neurosciences
Jocelyne Caboche, Trésorière, ancienne Trésorière de la Société
Frédéric Chavane, membre du CA, ancien Trésorier de la Société
Une nouvelle cible thérapeutique pour lutter contre les addictions ?
L’addiction aux substances d’abus est une maladie psychiatrique caractérisée par des comportements compulsifs de recherche et de consommation de drogues en dépit des conséquences néfastes pour l’individu ainsi qu’un taux élevé de rechute après l’abstinence. Une caractéristique commune à toutes les substances addictives est d’augmenter la concentration d’un neuromodulateur, la dopamine, au sein de régions cérébrales qui forment le circuit neuronal de la récompense. L’augmentation des taux de dopamine au sein de ce circuit neuronal altère durablement la transmission synaptique excitatrice, qui dépend du neurotransmetteur glutamate, et engendre la mise en place de comportements addictifs. A l’heure actuelle, il n’existe aucun traitement pharmacologique efficace pour lutter contre les addictions. L’identification des bases moléculaires responsables de ce « dialogue » néfaste entre la dopamine et le glutamate apparait donc comme un défi majeur qui peut contribuer au développement de stratégies thérapeutiques innovantes.
De multiple évidences indiquent que l’hétéromérisation, c’est à dire l’interaction physique directe, entre les récepteurs de la dopamine et ceux du glutamate est un mécanisme puissant par lequel des récepteurs partenaires modulent leurs fonctions de façon réciproque. Ces hétéromères sont des cibles moléculaires à part entière car ils possèdent des caractéristiques propres qui sont différentes de celles des récepteurs qui les composent. A ce titre, le ciblage de ces complexes de récepteurs présente un intérêt thérapeutique potentiel mais leur rôle dans la mise en place des comportements addictifs restait à démontrer. Les chercheurs impliqués dans ce travail collaboratif ont développé des techniques permettant de détecter in situ la proximité entre les récepteurs de la dopamine de type 1 (D1R) et 2 (D2R) avec les récepteurs du glutamate de type NMDA (NMDAR) dans le cerveau de souris exposées de manière répétées à la cocaïne. En se focalisant sur une structure cérébrale clé du circuit de la récompense, le noyau accumbens, les chercheurs ont montré que l’exposition à la cocaïne provoque une augmentation transitoire de l’hétéromérisation D1R-NMDAR dans cette structure cérébrale alors que celle des complexes D2R-NMDAR perdure dans le temps. Pour définir le rôle de chaque type d’hétéromère sur les différentes phases des réponses cellulaires, moléculaires et comportementales induites par la cocaïne les chercheurs ont mis au point une approche virale afin de bloquer l’un ou l’autre de ces hétéromères de récepteurs de manière contrôlée dans le temps, tout en préservant les fonctions des récepteurs partenaires indépendamment de leur interaction. Cette approche a permis d’établir que l’hétéromérisation D1R-NMDAR induite par la cocaïne dans le noyau accumbens contrôle le développement des altérations comportementales persistantes induites par cette drogue chez le rongeur. A l’inverse, l’hétéromérisation D2R-NMDAR joue un rôle clé dans le maintien au cours du temps de ces altérations comportementales. De plus, l’inhibition de l’un ou l’autre de ces complexes n’altère pas le traitement de récompenses naturelles telle que la nourriture. D’un point de vue translationnel, l’implication des interaction D2R-NMDAR dans le maintien des réponses à la cocaïne et leur absence d’impact sur le traitement des récompenses naturelle en font des cibles thérapeutiques potentielles pour lutter contre les addictions. Dans ce contexte, les chercheurs ont également démontré que ces complexes de récepteurs étaient détectables dans des tissus post-mortem humains, et que les individus avec un historique de dépendance aux psychostimulants présentaient une hétéromérisation D2R-NMDAR significativement accrue par rapport à des sujets sains.
Ces découvertes constituent une avancée significative dans la compréhension des bases moléculaires des adaptations induites par les substances addictives. Elles soulignent également l’intérêt potentiel de cibler l’hétéromérisation D2R-NMDAR, non seulement dans le domaine de la dépendance, mais potentiellement pour de nombreux troubles neuropsychiatriques associés à un déséquilibre des transmissions dépendantes de la dopamine et du glutamate, telles que la dépression et la schizophrénie.
Pour en savoir plus
Disrupting D1-NMDA or D2-NMDA receptor heteromerization prevents cocaine’s rewarding effects but preserves natural reward processing. Andry Andrianarivelo, Estefani Saint-Jour, Paula Pousinha, Sebastian P. Fernandez, Anna Petitbon, Veronique De Smedt-Peyrusse, Nicolas Heck, Vanesa Ortiz, Marie-Charlotte Allichon, Vincent Kappès, Sandrine Betuing, Roman Walle, Ying Zhu, Charlène Joséphine, Alexis-Pierre Bemelmans, Gustavo Turecki, Naguib Mechawar, Jonathan A Javitch, Jocelyne Caboche, Pierre Trifilieff, Jacques Barik, Peter Vanhoutte. Science Advances 2021 Oct 22;7(43):eabg5970. doi: 10.1126/sciadv.abg5970.
Contact chercheur
Peter Vanhoutte DR2-CNRS
Sorbonne Université, Laboratoire Neuroscience Paris-Seine, CNRS/UMR8246; INSERM/UMRS-1130; Paris