Un rôle anti-inflammatoire pour la molécule APRIL dans les lésions de sclérose en plaques
La sclérose en plaques (SEP) est une maladie neurodégénérative touchant le système nerveux central (SNC). La transmission de l’influx nerveux est perturbée par la destruction progressive de la gaine de myéline qui entoure et protège les axones neuronaux. Cette démyélinisation progressive d’origine autoimmune conduit à des troubles moteurs, sensitifs et cognitifs majeurs. Récemment, un essai clinique visant à bloquer la molécule « a proliferation inducing ligand (APRIL) », régulateur positif de la production d’anticorps, a montré une aggravation inattendue de la maladie.
Notre étude récente a permis de comprendre, tout du moins en partie, cet échec clinique. En effet, nous avons mis en évidence une nouvelle cible cellulaire pour la molécule APRIL dans le SNC, à savoir l’astrocyte réactionnel présent au sein des lésions de SEP. Nos résultats démontrent que la fixation d’APRIL sur les astrocytes induit une réponse anti-inflammatoire par la production d’IL-10 capable d’inhiber in vitro l’activation de lymphocytes T auto-réactifs dirigés contre la myéline. L’utilisation d’un modèle murin de la SEP nous a permis de confirmer in vivo le rôle anti-inflammatoire d’APRIL ; premièrement, des souris déficientes pour APRIL présentent une sévérité augmentée et deuxièmement, une réduction de la sévérité de la maladie est observée après injection d’APRIL recombinante dans ce modèle murin. Ces derniers résultats identifient la molécule APRIL comme traitement potentiel pour les phases aigües de poussées de SEP.
Référence
APRIL-mediated anti-inflammatory response of astrocytes in multiple sclerosis.
Baert L, Benkhoucha M, Popa N, Ahmed MC, Manfroi B, Boutonnat J, Sturm N, Raguenez G, Tessier M, Casez O, Marignier R, Ahmadi M, Broisat A, Ghezzi C, Rivat C, Sonrier C, Hahne M, Baeten D, Vives RR, Lortat-Jacob H, Marche PN, Schneider P, Lassmann HP, Boucraut J, Lalive P, Huard B. Ann Neurol, 2019 Jan 11 DOI: 10.1002/ana.25415
Contact chercheur
Bertrand Huard
Institut Albert Bonniot Centre de recherche UGA / Inserm U 1209 / CNRS UMR 5309.
bertrand.huard@univ-grenoble-alpes.fr
Trois neurotransmetteurs et la maladie de Parkinson
La perte de l’innervation dopaminergique des ganglions de la base et notamment du striatum dorsal (putamen) est à l’origine des signes moteurs de la maladie de Parkinson : une lenteur à exécuter les mouvements, une rigidité musculaire et des problèmes de posture. Si la quasi-totalité des neurones du striatum sont GABAergiques, seulement1% sont des interneurones cholinergiques. Ces interneurones géants génèrent une réponse caractéristique à un stimulus sensoriel associé à une récompense, une pause dans leur décharge, qui disparait dans le striatum privé de ses afférences dopaminergiques.
Un troisième neurotransmetteur,l’acide g-aminobutyrique (GABA), s’est invité dans la pathologie lorsque nous avons découvert qu’environ 50% des interneurones cholinergiques du striatum sont aussi GABAergiques, en nous basant sur des marqueurs (Lhx6), de la PCR intracellulaire (gad2) et des enregistrements de paires de neurones. Faiblement connectés entre eux chez les animaux témoins,ces interneurones mixtes libèrent acétylcholine et GABA, agissant sur des récepteurs nicotiniques et GABAA, pour générer des courants antagonistes, entrant et sortant, respectivement. Dans le striatum déplété endopamine, les connexions entre neurones mixtes augmentent et le courant GABAA devient entrant, tout comme le courant cholinergique, abolissant ainsi la« pause-réponse » évoquée par la stimulation des afférences corticales. Baisser les taux de (Cl–)i avec la bumétanide, un bloquant de l’importateur des ions chlorures, NKCC1, rétablit la polarité du courant GABAA et la pause-réponse in vitro. In vivo, le traitement chronique à la bumétanide des souris dont un des striatum est déplété en dopamine, améliore leur motricité.
En parallèle, nous avons conduit un essai clinique ouvert sur 4 patients avec des effets prometteurs de la bumétanide. Nous allons bientôt effectuer un essai en double aveugle sur 40patients, centré sur les problèmes de chute et de « freezing » des parkinsoniens. Collectivement, ces travaux illustrent l’importance du métabolisme neuronal des ions chlorures, perturbé dans de nombreuses pathologies neurologiques.
Three neurotransmitters and Parkinson disease
The progressive loss of dopaminergic innervation of the basal ganglia, in particular of the dorsal striatum (putamen) is responsible for the motor signs of Parkinson disease such as bradykinesia, rigidity and loss of postural reflexes. In the striatum, the vast majority of neurons are GABAergic, with cholinergic interneurons representing only 1% of the total population. These giant interneurons gradually develop a typical conditioned pause response during acquisition of a sensorimotor association. The proportion of these responsive interneurons is dramatically decreased in the dopamine-depleted striatum.
We recently identified a third player in the disease, the gamma-aminobutyric acid (GABA). On the basis of intracellular markers labeling (Lhx6), RTqPCR (gad2) and pair recordings, we showed that around 50% of cholinergic interneurons also synthesize and release GABA. Loosely interconnected in control striatum, these mixed interneurons generate inward nicotinic and outward GABAA currents. In the dopamine-depleted striatum, interconnections dramatically increase and the GABAA current becomes inward like the nicotinic one, leading to disappearance of the pause (suppression of firing) in response to cortical afferents stimulation. Application in slices of the blocker of the chloride importer NKCC1, bumetanide, to lower intracellular chloride concentration, reestablishes GABAAcurrent polarity and the pause response. Chronic bumetanide treatment ameliorates the motricity of mice with dopamine-depletion in one striatum.
In parallel, we conducted a promising open study with 4 patients which will be followed by a double-blind essay with 40 patients, targeting problems of posture, falls and freezing, in particular. Overall our studies illustrate the importance of neuronal chloride metabolism which is altered in a variety of neurological disorders.
Référence
GABAergic inhibition indual-transmission cholinergic and GABAergic striatal interneurons is abolishedin Parkinson disease. LozovayaN, Eftekhari S, Cloarec R, Gouty-Colomer LA, Dufour A, Riffault B, Billon-Grand M, Pons-Bennaceur A, Oumar N, Burnashev N, Ben-Ari Y, Hammond C.
Nat Commun. 2018 Apr 12;9(1):1422. doi: 10.1038/s41467-018-03802-y.
Contact chercheur
Constance Hammond
Inmed Inserm UMR 1249 et B&A Therapeutics, 163 avenue de Luminy, Marseille.
constance.hammond@inserm.fr
De nouveaux mécanismes à l’origine de la migraine
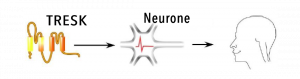
Des chercheurs du CNRS, d’Université Côte d’Azur et de l’Inserm ont mis en évidence un nouveau mécanisme lié à l’apparition de la migraine. En effet, une mutation génétique induit le dysfonctionnement d’une protéine normalement capable d’inhiber une activité électrique provoquant des crises migraineuses. Leurs résultats, publiés dans la revue Neuron le 17 décembre, ouvrent la piste pour l’élaboration d’antimigraineux.
Alors que 15% de la population adulte dans le monde est touchée par la migraine, aucun traitement curatif efficace sur le long terme n’a pour le moment été mis sur le marché. Les crises migraineuses sont liées, entre autres, à l’hyperexcitabilité électrique des neurones sensoriels. Leur activité électrique est contrôlée par des protéines génératrices de courant appelées canaux ioniques, et notamment par le canal TRESK qui a une fonction inhibitrice sur l’activité électrique. Or, les chercheurs ont montré qu’une mutation du gène codant pour cette protéine entraine sa scission en deux protéines dysfonctionnelles : l’une est inactive et l’autre, en ciblant d’autres canaux ioniques (K2P2.1) stimule fortement l’activité électrique des neurones, provoquant des crises migraineuses.
Si les chercheurs avaient déjà mis en évidence le caractère héréditaire des migraines, ils n’en connaissaient pas le mécanisme. En démontrant que la scission de TRESK induit l’hyperexcitabilité des neurones sensoriels et le déclenchement de la migraine, ces travaux, menés à l’Institut de biologie Valrose (CNRS/Inserm/Université Côte d’Azur), constituent une nouvelle piste de recherche pour l’élaboration d’antimigraineux. Ils font l’objet d’un brevet : l’idée est de cibler les canaux K2P2.1 afin de réduire l’activité électrique des neurones, prévenant ainsi le déclenchement de migraines.
De plus, les chercheurs proposent que ce mécanisme inédit, provoquant la formation de deux protéines au lieu d’une seule, soit maintenant considéré pour étudier d’autres maladies liées à des mutations génétiques ainsi que pour leur diagnostic.
Référence
Migraine-associated TRESK mutations increase neuronal excitability through alternative translation initiation and inhibition of TREK. Perrine Royal, Alba Andres-Bilbe, Pablo Ávalos Prado, Clément Verkest, Brigitte Wdziekonski, Sébastien Schaub, Anne Baron, Florian Lesage, Xavier Gasull, Joshua Levitz, Guillaume Sandoz, Neuron, December 17, 2018.
Contact chercheur
Guillaume Sandoz l T +33 4 92 07 68 04 l guillaume.sandoz@unice.fr
Les séquences neurales enchevêtrées sont indispensables à la formation de la mémoire !

De nombreuses fonctions cognitives semblent être sous-tendues au niveau cérébral par la formation de séquences d’activité neuronale, c’est-à-dire par l’activation successive d’ensembles spécifiques de neurones, dans un ordre bien précis. Ces fonctions sont variées, allant de la vocalisation chez les oiseaux, à la réactivation de souvenirs chez les primates, en passant par la discrimination d’odeurs chez les criquets, ou encore la planification et la prise de décision chez les rats. Les séquences d’activité peuvent se produire plus ou moins rapidement, depuis l’échelle de temps lente du comportement (c’est-à-dire conditionnée par la perception ou par l’action), jusqu’à l’échelle de temps rapide endogène (c’est-à-dire conditionnée par les propriétés intrinsèques des réseaux de neurones concernés). Un exemple particulièrement frappant est l’hippocampe, dont les cellules de lieu codent la position de l’animal dans l’environnement. Lorsque l’animal se déplace, les cellules de lieu s’activent les unes après les autres au fil de la trajectoire, ce qui forme des séquences d’activité à l’échelle de temps comportementale. Ensuite, pendant le sommeil, ces mêmes séquences se reproduisent spontanément, comme si l’animal « rêvait » des trajectoires qu’il vient de parcourir. Ces réactivations sont hautement accélérées, environs vingt fois plus rapides, et permettent de renforcer la mémoire pendant le sommeil. Comment l’organisation séquentielle des cellules de lieu peut-elle être maintenue à des échelles de temps si différentes, manifestées à des moments totalement séparés dans le temps, et dans des états cérébraux opposés (veille, sommeil) ?
Une première possibilité est que l’information séquentielle est directement enregistrée lorsque les neurones s’activent les uns après les autres à l’échelle de temps du comportement. Une seconde possibilité, plus énigmatique, met en jeu la remarquable propriété de l’hippocampe de générer des séquences d’activité enchevêtrées, c’est-à-dire mêlant de manière profondément intriquée des séquences lentes et des séquences rapides. Ceci se produit en fait pendant l’exploration : alors même que les cellules de lieu s’activent lentement les unes après les autres, le réseau hippocampique produit également des séquences d’activité à l’échelle de temps d’une oscillation cérébrale appelée « thêta », dont les cycles durent à peine 150 ms. Ceci permet aux cellules de lieu de s’activer de manière répétée, très rapidement les unes après les autres, comme si à chaque instant elles représentaient toute la trajectoire en cours. Grâce à leur vitesse élevée, ces séquences enchevêtrées permettraient aux cellules de lieu de renforcer leurs connexions, et ainsi de mémoriser leur séquence d’activation. Mais s’agit-il vraiment là du mécanisme qui permet à l’hippocampe de mémoriser des trajectoires, ou d’un simple épiphénomène, si frappant soit-il ?
Pour répondre à cette question, nous avons enregistré des séquences d’activité hippocampiques chez des rats, pendant l’exploration de l’environnement, et pendant le sommeil. Nous avons développé un protocole, grâce auquel nous avons pu perturber, de manière rapide et sélective, les séquences d’activité enchevêtrées, sans toucher aux séquences lentes. Ainsi, les cellules de lieu s’activaient-elles toujours les unes après les autres à mesure que les rats parcouraient l’environnement (à l’échelle de temps du comportement), mais les séquences enchevêtrées (à l’échelle de temps du rythme thêta) pouvaient être supprimées à volonté. Nous avons constaté que la perturbation des séquences enchevêtrées avait pour conséquence une absence totale de réactivations pendant la période de sommeil suivante, réactivations qui permettent normalement la consolidation de la mémoire. Ainsi est-ce bien grâce à son étonnante capacité à produire en même temps des séquences rapides et lentes, grâce à cet enchevêtrement des échelles de temps, que l’hippocampe peut mettre initialement en mémoire les souvenirs qui seront ensuite renforcés pendant le sommeil pour permettre une mémorisation à long terme.
Référence
Drieu C, Todorova R, Zugaro M.. Nested sequences of hippocampal assemblies during behavior support subsequent sleep replay. Science. 2018 Nov 9;362(6415):675-679. doi: 10.1126/science.aat2952.
Contact chercheur
Center for Interdisciplinary Research in Biology (CIRB), Collège de France, CNRS, INSERM, PSL Research University, Paris.
L’acétylcholine et les circuits neuronaux de la dépression
Selon l’Organisation Mondiale de la Santé, la dépression est un trouble mental courant affectant plus de 300 millions de personne dans le monde. L’apparition de troubles dépressifs est la conséquence d’une interaction complexe entre prédispositions génétiques et facteurs psychosociaux. Elle se caractérise notamment par une perte de plaisir (anhédonie) et l’évitement des autres (aversion sociale). Ces altérations comportementales peuvent être observées chez des souris soumises à des expériences traumatogènes comme un stress social. En effet, l’exposition répétée de souris à des congénères mâles dominants entraine l’apparition de troubles comportementaux caractéristiques de la dépression associés à la dérégulation d’un messager chimique du cerveau, la dopamine. Comprendre les mécanismes impliqués dans ces adaptations est un enjeu important pour le traitement des troubles psychiatriques liés au stress.
Les récents travaux de notre équipe au sein de l’Institut de Pharmacologie Moléculaire et Cellulaire, publiés dans la revue Nature Communications, ont dévoilé en partie les mécanismes neurobiologiques impliqués dans les troubles dépressifs. Nous avons identifié un circuit neuronal qui sous-tend la dérégulation des signaux dopaminergiques et l’apparition des comportements anhédoniques et d’aversion sociale. En effet, nous avons montré que l’exposition à un stress social chronique entraine une profonde dérégulation des neurones du noyau latérodorsal du tegmentum (LDTg), notamment ceux produisant l’acétylcholine, un messager chimique jouant un rôle important dans la modulation de l’activité des neurones dopaminergiques. Le blocage sélectif de l’activité de ces neurones par l’utilisation d’approches chimiogénétiques lors des phases d’exposition au stress est suffisante pour empêcher la cascade de réactions aboutissant à l’apparition des troubles comportementaux. La dérégulation des neurones à acétylcholine est causée par le relargage de corticolibérine et sa fixation sur le récepteur CRF de type 1 modulant directement l’activité des neurones cholinergiques.
Ces résultats pourraient mener à de nouvelles pistes thérapeutiques pour combattre la dépression, soit par des approches pharmacologiques contre les cibles moléculaires identifiées, soit par des approches permettant de moduler l’activité des macrocircuits mis en évidence.
Reference
Fernandez SP, Broussot L, Marti F, Contesse T, Mouska X, Soiza-Reilly M, Marie H, Faure P, Barik J.
Mesopontine cholinergic inputs to midbrain dopamine neurons drive stress-induced depressive-like behaviors.
Nat Commun. 2018 Oct 25;9(1):4449. doi: 10.1038/s41467-018-06809-7.
Contact chercheur
Jacques Barik
Université Côte d’Azur, Nice, 06560, France
Institut de Pharmacologie Moléculaire & Cellulaire, CNRS, UMR7275, Valbonne, France
barik@ipmc.cnrs.fr
Estimates from the WHO show that depression is one of the most common psychiatric disorders, affecting 300 million people worldwide. Depression appears to be the result of a complex interaction between genetic predisposition and psychosocial factors. Most common symptoms include decrease ability to experience pleasure (anhedonia) and strong withdrawal from social interaction. These behavioral traits can be modeled and studied in mice subjected to stressful events such as social defeat. Indeed, in mice repeated exposure to a dominant conspecific produces depressive-like behavioral alterations that have been associated with an imbalance in the brain neurotransmitter dopamine. Understanding the process underlying these mal-adaptations warrants better treatments for psychiatric disorders associated with stress.
In a recent work published by our team (Institute of Molecular and Cellular Pharmacology) in the journal Nature Communications, we unraveled a novel mechanism implicated in the neurobiology of depression. We identified a neuronal circuit that promotes a dysregulation in dopaminergic signaling and the appearance of social aversion and anhedonia, two hallmarks of depressive states. We showed that exposure to chronic social stress induces strong activation of cholinergic neurons in the laterodorsal tegmental (LDTg) nucleus, which are important regulators of dopamine neurons activity. Selective chemogenetic silencing of these cholinergic neurons during social stress exposure was sufficient to prevent the chain of events linked with maldaptive behavioral responses. The dysregulation of LDTg cholinergic neurons by stress involves the release of corticotrophin-releasing factor (CRF) and selective activation of CRF-1 receptors in these neurons.
These results will open up new avenues in the fight against depression, by pinpointing a molecular target for drug discovery, or alternatively by brain neuromodulation approaches on these newly described circuit mechanisms.
Les interneurones GABAergiques dans le striatum : à chacun son rôle !
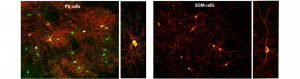
Dans le système nerveux central, les ganglions de la base sont responsables de la mise en place d’un comportement, depuis le contrôle moteur, la sélection d’une action jusqu’à la mise en place d’automatismes moteurs ; par exemple, une fois qu’on a appris à faire du vélo ou à jouer de la guitare, on s’en souvient toute sa vie. En tant que porte d’entrée des ganglions de la base, le striatum a pour rôle d’intégrer et sélectionner les informations venant du cortex qui sont les plus pertinentes pour commencer ou adapter une action. Pour cela le striatum reçoit de l’ensemble des aires corticales et les zones de convergence fonctionnelle définissent des grands territoires, le striatum dorsomedial (DMS) ou dorsolateral (DLS) responsables respectivement des aspects cognitifs et sensori-moteurs d’une action. Ces territoires sont responsables du traitement d’informations de nature très différente (cognitive vs. motrice) et pourtant rien d’évident dans l’anatomie ou la composition des réseaux neuronaux ne permet de comprendre ce qui forme leurs spécificités.
Comme de nombreuses structures du cerveau, les neurones principaux du striatum sont régulés par des microcircuits GABAergiques locaux formés par différents types d’interneurones inhibiteurs (qui représentent 5% de la population neuronal totale du striatum), les deux principaux étant les interneurones à parvalbumine (PV), les interneurones à somatostatine (SOM). Malgré leur faible proportion, les interneurones jouent un rôle important car ils contrôlent l’activité des neurones principaux.
Dans cette étude publiée dans Nature Communications, les chercheurs ont testé l’hypothèse que ces différents microcircuits GABAergiques locaux pourraient jouer un rôle dans la spécification des propriétés des réseaux neuronaux du DMS et du DLS.
Tout d’abord, ils ont exploré la distribution et les propriétés des interneurones PV et SOM dans le DMS et le DLS. Ces expériences ont mis en évidence des différences de densité cellulaire, de propriétés électrophysiologiques et de connectivité des interneurones PV et SOM en fonction de leur appartenance au DMS ou DLS. Grâce à une combinaison d’approches électrophysiologiques (in vivo et ex vivo) et d’optogénétique, les chercheurs ont exploré si ces propriétés entraînaient des différences dans leur fonction au sein des deux territoires. L’optogénétique permet de contrôler l’activité de neurones ciblés avec de la lumière ; les interneurones PV et SOM peuvent donc indépendamment être activés ou inhibés pour évaluer leur impact sur l’activité du striatum ou de ses structures cibles. L’utilisation de cette technique a permis de montrer que les deux microcircuits GABAergiques ont des fonctions différentes dans le DMS et le DLS : les interneurones PV exercent un contrôle efficace du DLS alors que les interneurones SOM ont un rôle prépondérant dans le DMS. Enfin, bien que les interneurones GABAergiques sont normalement cantonnés à un rôle d’inhibition, les chercheurs ont montré que, dans le DMS et le DLS, les deux types d’interneurones PV et SOM peuvent être soit inhibiteurs soit dépolarisants en fonction de l’état d’activité du striatum.
Il existe donc une répartition des tâches au sein des microcircuits GABAergiques dans le contrôle de l’activité striatale, directement relié aux propriétés des interneurones et un rôle double des interneurones qui s’adapte à l’état de l’activité du striatum. Cette sélectivité des microcircuits GABAergiques participe ainsi à la spécification des propriétés des réseaux cognitifs ou sensori-moteurs du striatum.
Référence :
Fino E, Vandecasteele M, Perez S, Saudou F, Venance L. Region-specific and state-dependent action of striatal GABAergic interneurons. Nat Commun. 2018 Aug 21; 9(1):3339.
Contact :
Elodie Fino
Grenoble Institute of Neuroscience
Chemin Fortuné Ferrini
38000 Grenoble
elodie.fino@univ-grenoble-alpes.fr
Changement nanoscopique, effet macroscopique : quand le récepteur NMDA régule l’adaptation synaptique
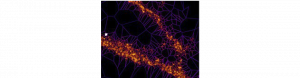
L’adaptation des synapses excitatrices est une des bases de la plasticité cérébrale, et implique le recrutement de récepteurs du glutamate de type NMDA. Des chercheurs de l’IINS (UMR 5297), du LP2N (Institut d’Optique), du University College London (UK), et de l’Université de Coimbra (Portugal) ont caractérisé l’organisation nanométrique de ces récepteurs aux synapses, et comment celle-ci influence leur adaptation. Publiés dans la revue Neuron, ces travaux apportent un éclairage nouveau sur les mécanismes à l’œuvre pendant l’apprentissage et la mémorisation.
En effet, les synapses glutamatergiques supportent l’essentiel des neurotransmissions excitatrices dans le cerveau et ont la capacité de s’adapter, un processus de plasticité généralement considéré comme une des bases de l’apprentissage et de la mémoire. Les récepteurs du glutamate de type NMDA (NMDAR) sont des acteurs clés de ces changements d’efficacité, et ont par conséquent été intensivement étudiés au cours des dernières décennies par manipulations génétiques ou pharmacologiques. Deux sous-types principaux de NMDAR, ceux contenant la sous-unité GluN2A ou GluN2B, influent directement sur la capacité de renforcement ou d’affaiblissement des synapses. De véritables régulateurs de l’adaptabilité des synapses excitatrices!
Néanmoins, nous n’avions jusqu’alors aucune vision de comment ces GluN2A- et GluN2B-NMDAR sont organisés au sein des synapses, de l’évolution de cette organisation au cours du développement, ni de comment cette organisation peut participer à la plasticité synaptique. En combinant des approches de microscopie de super-résolution et de d’électrophysiologie dans l’hippocampe, nous avons observé que les deux types de récepteurs sont organisés en nano-domaines distincts qui varient en nombre, surface, morphologie et localisation au cours du développement. Ces nano-domaines répondent à des mécanismes de régulation spécifiques à chaque sous-type de récepteurs impliquant des interactions avec des protéines d’échafaudage. Pour comprendre comment cette distribution nanométrique pouvait influer sur la signalisation synaptique, ils ont ensuite sélectivement désorganisé ces nano-domaines et, de manière inattendue, cela entrainait des changements bidirectionnels de la capacité d’adaptation des synapses! Ces découvertes révèlent pour la première fois que l’organisation nanométrique des récepteurs joue un rôle clé dans la plasticité des synapses. Elles apportent un éclairage nouveau sur notre compréhension des mécanismes moléculaires à l’œuvre lors des processus d’apprentissage et de mémorisation.
Nanoscopic change, macroscopic effect : when the NMDA receptor tunes the synaptic plasticity !
Glutamatergic synapses mediate most of excitatory neurotransmissions in the brain and have the ability to adapt their strength in response to salient environmental stimuli, a neuronal plasticity process that has been proposed to support learning and memory formation. NMDA glutamate receptors (NMDAR) were found to be central actors of these experience-dependent changes in transmission efficacy. Thus, they have been extensively studied over the past decades through genetic and pharmacological manipulations. These studies have revealed that two main subtypes of NMDAR can be found in the forebrain: those containing the GluN2A and those containing the GluN2B subunit, which display specific biophysical, pharmacological and signaling properties. An interesting feature of these two predominant subtypes is that their respective abundance at synapses changes along brain development or sensory experience, and directly influences the ability of synapses to strengthen or weaken.
However, how the spatial distribution of GluN2A- and GluN2B-NMDAR at synapses evolves during maturation or activity-elicited modifications, and how it may affect synaptic signaling and adaptation remained open questions. In a joint effort between researchers of IINS (University of Bordeaux/CNRS UMR 5297), LP2N (University of Bordeaux/Institut d’Optique), University College London (UK), and of the University of Coimbra (Portugal), we used super-resolution microscopy and electrophysiological recordings in hippocampal neurons to investigate the nanoscale organization of GluN2A- and GluN2B-NMDAR at synapses and how it influences their adaptation. Both receptor subtypes were found to be organized in separate nanodomains which varied in number, area, shape, and localization over the course of development. These nanodomains displayed regulation mechanisms that were specific to each receptor subtype and involved interactions with scaffolding proteins of the postsynaptic density. To explore how this finely controlled distribution may influence synaptic signaling, we then selectively disrupted the organization of either GluN2A- or GluN2B-NMDAR nanodomains. To our surprise, acting on one or the other allowed to bi-directionally influence the adaptation of synapses: while disorganizing GluN2A-NMDAR nanodomains enhanced the strengthening of neuronal connections, disrupting the organization of GluN2B-NMDAR resulted in the exact opposite! These investigations reveal for the first time that the nanoscale organization of receptors plays a key role in NMDAR signaling at synapses, and likely influences the plasticity of neuronal networks.
Pour en savoir plus
Kellermayer B*, Ferreira JS*, Dupuis J*, Levet F§, Grillo-Bosch D§, Bard L§, Linarès-Loyez J, Bouchet D, Choquet D, Rusakov DA, Bon P, Sibarita JB, Cognet L, Sainlos M, Carvalho AL, Groc LDifferential Nanoscale Topography and Functional Role of GluN2-NMDA Receptor Subtypes at Glutamatergic Synapses – Published: September 27, 2018 · DOI: https://doi.org/10.1016/j.neuron.2018.09.012
Contact chercheur
Laurent Groc
Institut Interdisciplinaire de Neurosciences
UMR5297 (CNRS/Université de Bordeaux)
146 rue Léo Saignat
CS 61292 Case 130
33076 Bordeaux Cedex
Tel: 05 33 51 47 62
laurent.groc@u-bordeaux.fr
Au delà des représentations sensorielles dans le cortex auditif primaire

Le cortex cérébral est classiquement décrit comme une chaine hiérarchique dans laquelle les aires primaires extraient et encodent les caractéristiques de bas-niveau des stimuli sensoriels, alors que les aires de plus haut-niveau représentent le sens du stimulus, en fonction du contexte et de l’environnement. Par exemple, dans le cas d’une tache de discrimination auditive, le cortex auditif primaire est sensé encoder la localisation, le timbre, la hauteur du stimulus, alors que les aires supérieure représentent le sens perceptuel du stimulus et la décision de l’animal.
Dans une étude publié dans Nature Communications, Sophie Bagur et collègues ont montré que le cortex auditif primaire encode toutefois bien davantage que les seules propriétés sensorielles des sons, et représente de manière précoce le sens du stimulus, de façon similaire au cortex frontal. Pour parvenir à cette conclusion, le groupe mené par Yves Boubenec et Srdjan Ostojic, les deux auteurs senior de cette étude, a comparé l’activité du cortex auditif du furet dans deux contextes différents : lorsque l’animal écoute passivement deux sons, et lorsqu’il discrimine de manière active les mêmes stimuli en répondant à l’un (son cible) et pas à l’autre. En analysant au niveau populationnel l’activité de l’ensemble des neurones enregistrés, les auteurs ont montré que le type de codage dépend de façon drastique du contexte. Dans le cas de l’écoute passive, l’activité représente comme attendu de façon symétrique les propriétés sensorielles des deux sons. Lors de la discrimination active, l’activité populationnelle amplifie par contre fortement le son cible, et reflète sa signification comportementale de façon analogue au cortex frontal. Ce changement induit par l’engagement dans la tâche repose en partie sur des modifications d’activité spontanée, suggérant un rôle nouveau pour celle-ci dans le codage.
Référence:
Bagur S, Averseng M, Elgueda D, David S, Fritz J, Yin P, Shamma S, Boubenec Y, Ostojic S. Go/No-Go task engagement enhances population representation of target
stimuli in primary auditory cortex. Nat Commun. 2018 Jun 28;9(1):2529. doi:10.1038/s41467-018-04839-9.
Contact chercheur:
Srdjan Ostojic
LNC2. Equipe. Network Dynamics and Computations.
Ecole Normale Superieure
29 rue d’Ulm
75005 Paris France
srdjan.ostojic@ens.fr
L’épigénétique au secours de la maladie d’Alzheimer !
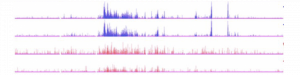
La maladie d’Alzheimer (MA) est une maladie neurodégénérative affectant les fonctions de la mémoire et conduisant progressivement à une perte neuronale massive et à une démence. Il n’y a actuellement aucun traitement curatif et certains essais cliniques récents ont échoué.
L’acétylation des histones est un régulateur essentiel de la structure de la chromatine et de l’expression des gènes. Notre étude démontre un dérèglement de l’acétylation de l’histone H2B dans l’hippocampe de souris développant des lésions neurofibrillaires, l’une des composantes pathologiques de la MA. Elle apporte en outre une preuve de concept qu’un traitement in vivo avec une molécule activatrice de l’acétyltransférase CBP / p300 (CSP-TTK21) rétablit les niveaux d’acétylation de H2B dans l’hippocampe et ainsi, restaure efficacement l’activité neuronale, la plasticité et la mémoire chez ce modèle de souris.
Rétablir une plasticité dans le cerveau malade en activant la fonction acétyltransférase de CBP/p300 constituerait donc une approche thérapeutique susceptible de retarder le déclin cognitif et d’améliorer les performances mnésiques chez les patients atteints de MA.
Référence
Reinstating plasticity and memory in a tauopathy mouse model with an acetyltransferase activator. Chatterjee S*, Cassel R*, Schneider-Anthony A*, Merienne K, Cosquer B, Tzeplaeff L, Halder Sinha S, Kumar M, Chaturbedy P, Eswaramoorthy M, Le Gras S, Keime C, Bousiges O, Dutar P, Petsophonsakul P, Rampon C, Cassel JC, Buée L, Blum D, Kundu TK, and Boutillier AL (2018). EMBO Molecular Medicine (Accepté le 5 septembre 2018) * co-premier auteurs
Contact
Anne-Laurence Boutillier
Laboratoire de Neurosciences Cognitives et Adaptatives (LNCA)
Equipe Dynamique de la mémoire & Epigénétique
UMR 7364 Unistra / CNRS
12, rue Goethe 67000 Strasbourg, France
Email : laurette@unistra.fr
Site web :http://lnca.fr/20.html
Tel: 03 68 85 19 34
Soigner l’addiction à la cocaïne avec la chirurgie !
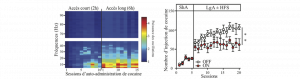
L’addiction est une maladie psychiatrique qui se caractérise par l’émergence de certains comportements pathologiques, tels que la perte progressive de contrôle de la consommation d’une substance (en termes de dose et de fréquence de consommation). Il n’existe à ce jour aucun médicament efficace pour bloquer le développement de cette escalade de la consommation ou normaliser cette perte du contrôle de la prise de drogue, notamment dans le cas de la cocaïne. L’équipe du Dr. Christelle Baunez à Marseille avait précédemment montré chez le rat que la stimulation cérébrale profonde du noyau subthalamique (NST ; qui est utilisée avec succès depuis deux décennies chez les patients parkinsoniens) réduisait la motivation des animaux à travailler pour obtenir de la cocaïne.
Dans cette nouvelle étude, l’équipe a donc testé le potentiel de la stimulation cérébrale profonde du NST sur l’escalade de la consommation de cocaïne, que l’on observe chez le rat en lui donnant quotidiennement un accès long à la drogue (6 heures / jour, pendant deux semaines). Les chercheurs ont tout d’abord enregistré l’activité du NST au cours du développement de l’escalade, grâce aux électrodes implantées dans celui-ci. Ils ont observé une augmentation progressive de l’activité basale (en absence de cocaïne) oscillatoire de basse fréquence dans le NST, en parallèle de la perte de contrôle de la consommation de cocaïne des animaux. De façon intéressante, ce type d’activité pathologique du NST a également été observé dans la maladie de Parkinson. L’équipe du Dr. Baunez a mis en évidence que bloquer le développement de ces activités oscillatoires pathologiques en appliquant la stimulation du NST à 130 Hz a un effet préventif sur le développement de la perte de contrôle, puisque les animaux stimulés n’augmentent pas leur consommation lors de l’accès prolongé à la cocaïne. Outre les effets préventifs de la stimulation à haute fréquence du NST, les auteurs montrent également que cette stimulation peut avoir un effet thérapeutique en terme de diminution de la rechute lors d’une ré-escalade suivant une période d’abstinence.
Ces travaux menés en collaboration étroite entre des équipes de recherche de Marseille (Christelle Baunez), de Bordeaux (Serge Ahmed) et du Scripps Research Institute de San Diego-USA (Olivier George et George Koob) fournissent donc des évidences précliniques concrètes quant à une utilisation potentielle de la stimulation cérébrale profonde du NST pour réduire la consommation excessive de drogues chez les toxicomanes.
Publication
Pelloux Y*, Degoulet M*, Tiran-Cappello A, Cohen C, Lardeux S, Georges O, Koob GF, Ahmed SH, Baunez C. Subthalamic nucleus inactivation prevents and reverses escalated cocaine use. Mol. Psychiatry. 2018 (sous presse, doi : 10.1038/s41380-018-0080-y).
Contact :
Institut de Neurosciences de la Timone
UMR CNRS 7289
27, blv Jean Moulin
13005 Marseille