Sin categorizar
Formation des neurones sensoriels : un processus dynamique finement régulé
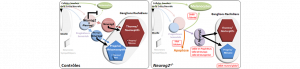
Notre capacité à détecter et intégrer diverses modalités sensorielles telles que le toucher (mécanoception), l’état d’étirement de nos muscles et la position de notre corps dans l’espace (proprioception), la température (thermoception) ou la douleur (nociception) repose sur le système nerveux somatosensoriel. Dans le tronc, les récepteurs primaires de ce système, localisés dans les ganglions rachidiens dorsaux (GRD), forment une population neuronale hétérogène dont la diversité fonctionnelle est établie tôt au cours de l’embryogenèse. Les neurones des GRD se forment à partir de cellules souches (ou progéniteurs) issues de la crête neurale qui contribuent également à ce niveau aux neurones sympathiques, aux cellules gliales périphériques ainsi qu’aux mélanocytes (les cellules pigmentaires de la peau). Le choix entre ces différents destins cellulaires implique des modifications du potentiel développemental des cellules de la crête neurale en fonction du temps et/ou de l’environnement, notamment reflétées par l’induction de déterminants spécifiques à chaque lignage. Dans les progéniteurs somatosensoriels, les facteurs de transcription Neurog1 et Neurog2 ont été identifiés depuis longtemps comme acteurs essentiels à la différentiation des différents sous-types neuronaux en agissant de manière a priori indépendante et complémentaire. Il est en effet généralement admis qu’un premier groupe de progéniteurs se différencie sous le contrôle de Neurog2 pour générer d’abord les neurones mécanoceptifs et proprioceptifs, puis qu’un second groupe se différencie plus tard sous l’action de Neurog1 pour produire les neurones thermo/nociceptifs. Ce modèle est supporté par l’absence totale de GRD chez les animaux doubles-mutants Neurog1-/- ;Neurog2-/-, ainsi que par l’agénésie spécifique des neurones « tardifs » thermo/nociceptifs chez les simples-mutants Neurog1-/-. Cependant, il n’existe pas d’évidence directe conférant un rôle spécifique à Neurog2 dans la formation des neurones « précoces » mécano/proprioceptifs, aucune perte neuronale n’ayant été décrite chez les simples-mutants Neurog2-/-. De fait, la contribution individuelle de Neurog2 dans ce système restait étonnamment vague. Au cours d’une étude récente, nous avons mis en évidence que les GRD des mutants Neurog2-/- contiennent en fait un nombre globalement réduit de neurones de tous types, concernant non seulement la population mécano/proprioceptive mais aussi, de manière plus inattendue, la population thermo/nociceptive. Nous avons établi que ce phénotype général -bien que partiel- est très dynamique et est la conséquence de multiples défauts affectant l’intégrité de différents pools de progéniteurs qui surviennent tous pendant une courte fenêtre de temps au cours de laquelle Neurog2 régule transitoirement l’expression de Neurog1 et l’initiation des différentes vagues de différentiation. Nous avons notamment montré que durant cette période, certains progéniteurs dédiés au système somatosensoriel changent d’identité et adoptent un destin de mélanocytes, tandis que d’autres meurent par apoptose. Ainsi, lorsque Neurog1 est finalement induit chez les mutants Neurog2-/-, la neurogenèse est initiée de manière retardée, à partir d’un réservoir restreint de progéniteurs, expliquant à terme le déficit neuronal observé. Ces résultats ont ainsi révélé l’existence d’une période critique de vulnérabilité et de plasticité développementale parmi les populations de progeniteurs somatosensoriels. Ils ont aussi permis de déterminer qu’au cours de la formation des GRD, le rôle de Neurog2 est plus complexe et plus large qu’initialement envisagé.
Reference:
Neurog2 Deficiency Uncovers a Critical Period of Cell Fate Plasticity and Vulnerability among Neural-Crest-Derived Somatosensory Progenitors. Ventéo S, Desiderio S, Cabochette P, Deslys A, Carroll P, Pattyn A. Cell Rep. 2019 Dec 3;29(10):2953-2960
Contact chercheur:
Institute for Neurosciences of Montpellier, University of Montpellier, INSERM U1051, Montpellier, France.