Uncategorized
Caféine : ses effets moléculaires décryptés dans le cerveau
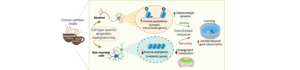
Des chercheurs de l’Inserm/Université et CHU de Lille et du CNRS/Université de Strasbourg décryptent les mécanismes moléculaires qui sous-tendent les effets de la caféine dans le cerveau. Ces travaux, réalisés chez la souris et publiés dans la revue The Journal of Clinical Investigation, renforcent l’idée d’un effet bénéfique de la caféine sur les fonctions cognitives.
La caféine est la substance psychoactive la plus consommée au monde. Alors que ses effets sur la vigilance et l’attention sont largement connus, les mécanisme moléculaires cérébraux associés à sa consommation régulière demeuraient peu connus jusqu’à présent. Le Dr. David Blum du laboratoire « Alzheimer & Tauopathies » du centre de recherche Lille Neuroscience & Cognition (Inserm/Université Lille/CHU de Lille) en collaboration avec le Dr. Anne-Laurence Boutillier du laboratoire de neurosciences cognitives et adaptatives (CNRS/Université de Strasbourg) vient de démontrer, chez la souris, qu’une consommation habituelle de caféine induit des changements moléculaires durables dans l’hippocampe, une structure essentielle à la mémoire et qui dégénère dans la maladie d’Alzheimer. Les résultats montrent notamment que la caféine modifie de manière très importante l’épigénome hippocampique de manière différenciée selon qu’il s’agisse des cellules neuronales ou non-neuronales. Cela concourrait à favoriser le traitement de l’information en réponse à une tache d’apprentissage, en exerçant une action concertée sur les cellules neuronales et non-neuronales.
Cette étude fait écho aux travaux précédents du laboratoire Alzheimer & Tauopathies suggérant un impact bénéfique de cette molécule dans le contexte de la maladie d’Alzheimer et à l’essai clinique de phase III en cours (CAFCA).
English summary
Caffeine is the most widely consumed psychoactive drug. However, there is a striking mismatch between the epidemiological evidence associating the regular intake of caffeine with benefits for chronic brain disorders and the molecular clarification of the impact of caffeine on brain function. Herein, using a combination of different non-hypothesis driven-omic approaches, we show that, in the bulk tissue analysis, chronic caffeine treatment reduced metabolic processes related to lipids, mitochondria and translation in the mouse hippocampus, some of which were identified at the different molecular levels analyzed, i.e. epigenome, transcriptome, proteome and metabolome. In sharp contrast to what was observed in bulk tissue, we found that caffeine induced a neuronal autonomous epigenomic response related to synaptic plasticity activation. These data were corroborated by the fact that caffeine treatment induced an increase in glutamatergic synapse proteins in the hippocampus and ultimately, enhanced transcriptomic regulations in response to learning. Overall, our data prompt the novel concept that regular caffeine intake promotes a more efficient ability of the brain to encode experience-related events. By coordinating epigenomic changes in neuronal and non-neuronal cells, regular caffeine intake promotes a fine-tuning of metabolism in resting conditions, likely improving neuronal activity in response to learning.
Source
Paiva I, Cellai L, Meriaux C, Poncelet L, Nebie O, Saliou JM, Lacoste AS, Papegaey A, Drobecq H, Le Gras S, Schneider M, Malik EM, Müller CE, Faivre E, Carvalho K, Gomez-Murcia V, Vieau D, Thiroux B, Eddarkaoui S, Lebouvier T, Schueller E, Tzeplaeff L, Grgurina I, Seguin J, Stauber J, Lopes LV, Buée L, Buée-Scherrer V, Cunha RA, Ait-Belkacem R, Sergeant N, Annicotte JS, Boutillier AL, Blum D (2022) Caffeine intake exerts dual genome-wide effects on hippocampal metabolism and learning-dependent transcription. The Journal of Clinical Investigation. https://doi.org/10.1172/JCI149371
Contact chercheurs
David Blum
Directeur de recherche Inserm
Lille Neuroscience & Cognition
UMR-S 1172 (Inserm/ Univ. Lille/CHU Lille)
Equipe “Alzheimer & Tauopathies” – LabEx DISTALZ
Tél : 06 50 82 04 90
Anne-Laurence Boutillier
Directrice de recherche Cnrs
UMR7364 (Cnrs/université de Strasbourg)
Equipe « Epigenetics & Memory dynamics »
Tél : 03 68 85 19 34
International Congress for FrontoTemporal Dementias
The city of Lille is pleased to host the 12th biennial congress of the ISFTD from November 2 to 5, 2022 in Lille Grand Palais after having been held in the cities of Syndey, Munich or Vancouver.
This congress, preceded by a symposium at the Paris Brain Institute, will be an opportunity to bring together clinicians, researchers, psychologists, nurses and students to advance the understanding of frontotemporal dementia.
This event will also be an opportunity for caregivers to meet on Friday, November 4th, for a day dedicated to them in parallel with the medical-scientific sessions.
For more information, please visit our website.
Visioconférence “Jeux vidéo et neurosciences” par l’Union des Savoirs
La notion d’expérience utilisateurs (UX) est encore récente dans l’industrie du jeu vidéo, et constitue un grand défi, les jeux devant être amusants et engageants. Comment les connaissances en sciences cognitives et en ergonomie peuvent aider à atteindre cet objectif ? Quels éléments expliquent le succès d’un jeu ? Comment adopter une approche UX pour n’importe quel autre produit, application, ou service ? Ancienne directrice UX chez Epic Games avec plus de 13 ans d’expérience dans l’industrie du jeu, Celia Hodent répondra à ces questions et celles que vous lui poserez. Elle nous révélera quelques concepts clefs de psychologie cognitive et nous expliquera le cadre de travail qu’elle a développé et notamment utilisé pour le développement du jeu Fortnite, succès planétaire.
Cette conférence d’une heure trente (en comptant les échanges avec le public) aura lieu en ligne. Il est nécessaire de s’inscrire afin d’obtenir le lien pour se connecter. Une fois votre billet pris, nous vous enverrons par mail toutes les informations liées à la connexion un peu avant l’événement. Surveillez vos spams !
Par Célia Hodent :
Détentrice d’un doctorat en psychologie (Paris V), Celia Hodent est experte en UX (expérience utilisateur), spécialisée dans l’application des sciences cognitives afin d’améliorer des produits ou systèmes (ergonomie cognitive), plus particulièrement les jeux vidéo dans le but d’en rendre l’expérience plus intuitive et fun pour les joueurs. Par son travail chez Ubisoft, LucasArts, et en tant que Directrice UX chez Epic Games (Fortnite), elle a contribué à de nombreux projets sur de multiples plateformes (jeux PC, consoles, mobiles, et VR).
Celia est auteure des livres Dans le cerveau du gamer : Neurosciences et UX dans la conception de jeux vidéo et The Psychology of Video Games. Elle travaille depuis 2017 comme consultante indépendante afin d’accompagner les entreprises sur les sujets de l’expérience utilisateurs, l’éthique en tech, les biais inconscients et l’inclusion. Celia est également la fondatrice du Game UX Summit, de l’initiative ethicalgames.org, et est membre du Comité de la Prospective de la CNIL.
Twitter: @CeliaHodent
Blog: celiahodent.com
We support our colleagues affected by the war in Ukraine

To all neuroscientists whose life and work have been affected by the Ukraine war: we stand with you and offer support. Below are listed a number of infos & resources should you want to relocate to France :
Усім нейробіологам, чиє життя та діяльність постраждали від війни в Україні: ми з вами та підтримуємо.
Нижче наведено деяку інформацію та ресурси, якщо ви хочете переїхати у Францію:
Всем нейроучёным, на чью жизнь и работу повлияла война в Украине: мы с вами и предлагаем вам поддержку.
Ниже вы найдете информацию и ресурсы, которые помогут вам переехать во Францию:
English version (updated April 4, 2022)
Ukrainian version (updated April 4, 2022)
The Federation of European Neuroscience Societies (FENS) also lists information. See their website.
Pour les neuroscientifiques en France, voici ce que vous pouvez faire :
1) Faites savoir que vous êtes prêt·e·s à aider
– faites savoir que vous pourriez héberger un·e scientifique (chercheur.e, post-doc, étudiant.e) sur le site ScienceForUkraine
Vous pouvez soumettre votre annonce ici.
– la FENS permet de déposer des annonces ciblant les scientifiques d’Ukraine. Voir leur site web.
– une autre liste, très utilisée en Pologne, où vous pouvez vous faire connaître : formulaire pour soumettre une annonce ici.
2) Financer l’accueil d’un·e scientifique par le programme PAUSE
Informations sur le site web dédié.
En bref :
– il y a deux programmes :
• un programme spécifique pour les scientifiques arrivant d’Ukraine, avec une aide financière d’urgence de 3 mois, un dossier léger et une évaluation au fil de l’eau ;
• un programme pour tou·te·s les scientifiques en danger hors UE, avec un apport du programme PAUSE jusqu’à hauteur de 60% du salaire ; le dossier est un peu plus complet, avec 3 appels par an.
– Votre interlocuteur·trice est le ou la responsable des relations internationales de votre institution, qui vous aidera à monter le dossier et fera la liaison avec le programme PAUSE
3) Pensez à proposer la possibilité de travail à distance
De nombreux scientifiques et étudiant·e·s restent en Ukraine et sont à la recherche de possibilités de travail à distance, de contacts, de mentoring.
N’hésitez pas à proposer du travail à distance, si votre domaine s’y prête.
Vous pouvez poster les annonces pour du travail à distance sur Science for Ukraine.
Il existe aussi des sites dédiés notamment pour le mentoring, l’offre de cours en ligne, etc.. vous trouverez plus d’infos ici.
et là.
Photo exhibition for FENS Forum 2022

The French Neuroscience Society is hosting the FENS Forum 2022. This is a great opportunity to showcase the richness of the French neuroscience community. With the Local Organising Committee, we want to set up a photo exhibition, which will be presented during the Forum and which will then be able to tour the various institutes and laboratories throughout France, so that everyone can discover the whole range of neuroscience.
Do you have stunning, funny or curious images? Share them with us to create this exhibition!
Deadline for submissions: 15 April 2022.
In practice, the photos must
– have been taken by you and have not had their copyright transferred (for an article, a book)
– be available in high resolution (ideally: .TIFF, 8bits RGB, 10.000 pixels for the large side) for large format printing.
For the time being we ask you to send us to info@societe-neurosciences.fr the photo(s) in low resolution, 6MB maximum, ideally in JPEG, with a short description including a title or a sentence of explanation, the name of the person who took the photo and the name of the laboratory.
This first step will give us an idea of the material available. In a second step we will collect the high resolution images.
Thank you in advance for your contributions!
Appel à participation Collège des Sociétés Savantes Académiques de France
Mise en place de la commission doctorat du COSSAF
Le doctorat est le plus haut diplôme universitaire, et la signature du monde académique. En dépit de sa valeur, il est insuffisamment valorisé. Le devenir des docteures et docteurs doit être un des chantiers prioritaires du Collège des Sociétés Savantes.
Comme cela a été annoncé dans leur deuxième bulletin Collège-info, le COSSAF a mis en place une commission sur le doctorat, coordonnée par Dominique Valérian, et comprenant actuellement Patrick Lemaire, Benoît Schoefs et Marc Shapiro. Cette commission, pour remplir ses missions, doit maintenant s’élargir (une dizaine de membres permanents).
Si vous êtes intéressé·e·s à contribuer à ces travaux, merci de contacter Dominique Valérian, d’ici le 30 novembre.
Les travaux de cette commission ont pour objectifs de réfléchir aux conditions de préparation du doctorat et d’améliorer l’insertion des docteurs, dans et hors de l’enseignement supérieur et de la recherche.
A très court terme, les travaux de la commission doivent contribuer à la préparation, en cours, d’un nouvel arrêté devant remplacer l’arrêté de 2016 fixant le cadre national de la formation et les modalités conduisant à la délivrance du diplôme national de doctorat. Le nouvel arrêté devrait conduire à des modifications dans la préparation du doctorat.
A plus long terme, l’objectif de la commission sera de promouvoir une meilleure reconnaissance du doctorat et des compétences des docteurs au-delà des carrières de l’ESR : dans les entreprises, dans les hautes fonctions publiques mais aussi dans l’éducation nationale. Pour atteindre ce but, des enquêtes et des entretiens seront conduits, afin de collecter des données permettant de dresser un bilan de la situation actuelle et de faire des comparaisons internationales. L’analyse des données récoltées débouchera sur la formulation de propositions à destination des décideurs politiques et économiques, mais aussi des doctorants, de leurs encadrants et des écoles doctorales.
Les compétences que nous recherchons sont variées : des membres d’une commission doctorat (pour les sociétés savantes qui ont une telle commission), des spécialistes d’informatique capables de collecter et agréger des données sur la présence des docteurs dans différents secteurs d’activité en France et dans d’autres pays (ex. LinkedIn, Twitter, sites ministériels), des doctorants ou jeunes docteurs, des responsables universitaires, d’école doctorales ou de collèges doctoraux, et plus généralement toute personne qui a à cœur que les jeunes que nous formons puissent avoir une vie professionnelle aussi riche que celle de leurs homologues étrangers et utile à la société française.
Dominique Valérian, Patrick Lemaire, Benoît Schoefs et Marc Shapiro
Actions du Fonds de dotation NeuroCitoyen

Message de la gouvernance du Fonds de dotation NeuroCitoyen à destination de la communauté des chercheur·e·s en neurosciences.
La place des neurosciences dans la société : à la croisée des mondes
Les Neurosciences occupent une place tout à fait particulière dans le domaine des disciplines scientifiques, pour au moins trois raisons principales :
- Elles ont la caractéristique unique d’être au croisement de différentes disciplines : biologie et médecine; mathématiques et physique; psychologie, linguistique et philosophie; intelligence artificielle et science des données, pour ne citer que les principales.
- Elles s’intéressent à l’organe le plus mystérieux des systèmes biologiques, le cerveau. En cela, elles s’attaquent, peut être avec l’astrophysique, à l’un des derniers remparts majeurs, de nos connaissances scientifiques.
- Elles ont, de par la mise en œuvre de leurs concepts et leurs domaines d’application, des retentissements éclairants sur la Société et nos concitoyen·ne·s, qui montrent, au travers de leur participation massive à la Semaine du Cerveau, notamment, un appétit considérable pour tout ce qui concerne la connaissance du cerveau et pas seulement en rapport avec les pathologies.
Les sociétés savantes et leur place dans la société
Les Sociétés savantes, dans leur ensemble -et la Société des Neurosciences n’y échappe pas-, souffrent de plus en plus d’un manque de soutien institutionnel alors qu’elles sont en particulier le creuset de la transmission de nos connaissances et de leur partage avec le grand public. Leur situation financière, dès lors, est devenue difficilement viable et s’est aggravée par les deux années difficiles que nous venons de traverser, du fait de l’annulation de la plupart des évènements où elles trouvaient, non seulement un nécessaire terrain d’échanges et de rencontres particulièrement profitables à nos jeunes en formation, mais aussi, il faut le reconnaître, quelques moyens pour les faire vivre et permettre à ces Sociétés de remplir leurs missions.
Le lancement du Fonds NeuroCitoyen, une initiative innovante
C’est dans ce contexte que la Société des Neurosciences a créé le Fonds de dotation NeuroCitoyen, permettant de faire appel au soutien et à la générosité du public, particuliers et entreprises, tout en autorisant la défiscalisation des dons à hauteur de 66% pour les particuliers et de 60% pour les entreprises.
Ce fonds, pionnier dans le domaine, a été pensé avec comme mission principale de promouvoir le partage des connaissances avec les citoyen·ne·s, par le biais de manifestations grand public et de rapports d’expertise, sur des sujets à forts enjeux stratégiques ou éthiques. Ses missions sont aussi de connecter la recherche et la formation des jeunes chercheur·e·s et d’accroitre les échanges de connaissance avec la clinique et le monde socio-économique.
Il devient, en particulier
- un support important de la Semaine du Cerveau, par le biais d’un appel à dons.
- un outil pour soutenir les jeunes chercheur·e·s
- un levier pour rapprocher la recherche du monde socio-économique
Il sera le promoteur d’initiatives innovantes pour rapprocher la société civile et la recherche dans le domaine des neurosciences.
Pourquoi nous rejoindre dans cette aventure inédite ?
Nous avons besoin de vos idées et partages pour assurer la pleine réussite de cette initiative inédite et pionnière !
En créant un lien direct entre les neuroscientifiques et les citoyen·ne·s, nous sommes convaincus que le fonds de dotation sera un instrument à la fois original mais surtout opportun, pour promouvoir un vrai dialogue symbiotique, riche d’échanges fructueux.
Votre aide est précieuse pour contribuer aux idées, lancer une initiative qui vous tient à cœur ou pour renforcer notre lien avec les acteur·trice·s de la société civile (particuliers et monde socio-économique).
Vous êtes intéressé·e·s ? Contactez-nous !
Comment nous aider à court terme ?
Partagez le lancement de ce fonds NeuroCitoyen auprès de vos ami·e·s, familles, contacts professionnels, vos réseaux !
- Manifestez-vous auprès de nous si vous avez la volonté de nous aider dans le cadre du lancement du fonds
- Identifiez des acteur·trice·s qui pourraient être nos partenaires « bâtisseurs » du Fonds NeuroCitoyen
- Relayez notre appel au don sur vos réseaux : tout le monde doit se sentir concerné dans un esprit de partage et de soutien à la Société des Neurosciences. Il n’y a pas de « petits dons », y compris « l’euro symbolique » qui sera le bienvenu !
- Guettez les réseaux sociaux, nous allons communiquer largement dans les semaines à venir.
Vous êtes intéressé·e·s ? Contactez-nous :
André Nieoullon, Président du CA du Fonds NeuroCitoyen, ancien Président de la Société des Neurosciences
Jocelyne Caboche, Trésorière, ancienne Trésorière de la Société
Frédéric Chavane, membre du CA, ancien Trésorier de la Société
Une nouvelle cible thérapeutique pour lutter contre les addictions ?
L’addiction aux substances d’abus est une maladie psychiatrique caractérisée par des comportements compulsifs de recherche et de consommation de drogues en dépit des conséquences néfastes pour l’individu ainsi qu’un taux élevé de rechute après l’abstinence. Une caractéristique commune à toutes les substances addictives est d’augmenter la concentration d’un neuromodulateur, la dopamine, au sein de régions cérébrales qui forment le circuit neuronal de la récompense. L’augmentation des taux de dopamine au sein de ce circuit neuronal altère durablement la transmission synaptique excitatrice, qui dépend du neurotransmetteur glutamate, et engendre la mise en place de comportements addictifs. A l’heure actuelle, il n’existe aucun traitement pharmacologique efficace pour lutter contre les addictions. L’identification des bases moléculaires responsables de ce « dialogue » néfaste entre la dopamine et le glutamate apparait donc comme un défi majeur qui peut contribuer au développement de stratégies thérapeutiques innovantes.
De multiple évidences indiquent que l’hétéromérisation, c’est à dire l’interaction physique directe, entre les récepteurs de la dopamine et ceux du glutamate est un mécanisme puissant par lequel des récepteurs partenaires modulent leurs fonctions de façon réciproque. Ces hétéromères sont des cibles moléculaires à part entière car ils possèdent des caractéristiques propres qui sont différentes de celles des récepteurs qui les composent. A ce titre, le ciblage de ces complexes de récepteurs présente un intérêt thérapeutique potentiel mais leur rôle dans la mise en place des comportements addictifs restait à démontrer. Les chercheurs impliqués dans ce travail collaboratif ont développé des techniques permettant de détecter in situ la proximité entre les récepteurs de la dopamine de type 1 (D1R) et 2 (D2R) avec les récepteurs du glutamate de type NMDA (NMDAR) dans le cerveau de souris exposées de manière répétées à la cocaïne. En se focalisant sur une structure cérébrale clé du circuit de la récompense, le noyau accumbens, les chercheurs ont montré que l’exposition à la cocaïne provoque une augmentation transitoire de l’hétéromérisation D1R-NMDAR dans cette structure cérébrale alors que celle des complexes D2R-NMDAR perdure dans le temps. Pour définir le rôle de chaque type d’hétéromère sur les différentes phases des réponses cellulaires, moléculaires et comportementales induites par la cocaïne les chercheurs ont mis au point une approche virale afin de bloquer l’un ou l’autre de ces hétéromères de récepteurs de manière contrôlée dans le temps, tout en préservant les fonctions des récepteurs partenaires indépendamment de leur interaction. Cette approche a permis d’établir que l’hétéromérisation D1R-NMDAR induite par la cocaïne dans le noyau accumbens contrôle le développement des altérations comportementales persistantes induites par cette drogue chez le rongeur. A l’inverse, l’hétéromérisation D2R-NMDAR joue un rôle clé dans le maintien au cours du temps de ces altérations comportementales. De plus, l’inhibition de l’un ou l’autre de ces complexes n’altère pas le traitement de récompenses naturelles telle que la nourriture. D’un point de vue translationnel, l’implication des interaction D2R-NMDAR dans le maintien des réponses à la cocaïne et leur absence d’impact sur le traitement des récompenses naturelle en font des cibles thérapeutiques potentielles pour lutter contre les addictions. Dans ce contexte, les chercheurs ont également démontré que ces complexes de récepteurs étaient détectables dans des tissus post-mortem humains, et que les individus avec un historique de dépendance aux psychostimulants présentaient une hétéromérisation D2R-NMDAR significativement accrue par rapport à des sujets sains.
Ces découvertes constituent une avancée significative dans la compréhension des bases moléculaires des adaptations induites par les substances addictives. Elles soulignent également l’intérêt potentiel de cibler l’hétéromérisation D2R-NMDAR, non seulement dans le domaine de la dépendance, mais potentiellement pour de nombreux troubles neuropsychiatriques associés à un déséquilibre des transmissions dépendantes de la dopamine et du glutamate, telles que la dépression et la schizophrénie.
Pour en savoir plus
Disrupting D1-NMDA or D2-NMDA receptor heteromerization prevents cocaine’s rewarding effects but preserves natural reward processing. Andry Andrianarivelo, Estefani Saint-Jour, Paula Pousinha, Sebastian P. Fernandez, Anna Petitbon, Veronique De Smedt-Peyrusse, Nicolas Heck, Vanesa Ortiz, Marie-Charlotte Allichon, Vincent Kappès, Sandrine Betuing, Roman Walle, Ying Zhu, Charlène Joséphine, Alexis-Pierre Bemelmans, Gustavo Turecki, Naguib Mechawar, Jonathan A Javitch, Jocelyne Caboche, Pierre Trifilieff, Jacques Barik, Peter Vanhoutte. Science Advances 2021 Oct 22;7(43):eabg5970. doi: 10.1126/sciadv.abg5970.
Contact chercheur
Peter Vanhoutte DR2-CNRS
Sorbonne Université, Laboratoire Neuroscience Paris-Seine, CNRS/UMR8246; INSERM/UMRS-1130; Paris
Rnd2 : un nouveau lien moléculaire entre la génération de nouveaux neurones à l’âge adulte et l’anxiété
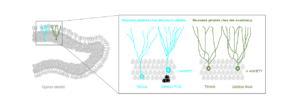
Dans la plupart des structures du cerveau, la neurogénèse ou l’ensemble du processus de formation d’un neurone fonctionnel à partir d’une cellule souche neurale, se déroule pendant l’embryogenèse et les premières semaines de vie. Toutefois, le processus est différent dans quelques rares régions cérébrales. Ainsi, dans le gyrus denté (GD) de la formation hippocampique, la production de nouveaux neurones se poursuit à l’âge adulte et perdure tout au long de la vie, faisant du GD une structure singulière du cerveau. La neurogénèse adulte dans l’hippocampe est bien démontrée chez la plupart des mammifères et son existence chez l’Homme, sujet d’intenses débats, est maintenant établie. En raison du rôle clé joué par ce processus dans la physiologie et la physiopathologie de la formation hippocampique, la compréhension des mécanismes qui président le développement et l’intégration des néo-neurones dans le cerveau adulte est capitale.
Dans ce contexte, nos travaux se sont concentrés sur l’étude de Rnd2, une protéine qui a un rôle clé au cours du développement neuronal embryonnaire et dont l’expression est particulièrement enrichie dans la zone du GD où sont générés et localisés les néo-neurones. En supprimant l’expression de Rnd2 spécifiquement dans les néo-neurones hippocampiques, nous avons observé une diminution de la survie de ces cellules, et dans les cellules ayant survécu, une modification de leur positionnement, leur morphologie et leur excitabilité. Nous avons également montré que les souris pour lesquelles Rnd2 a été supprimé dans les néo-neurones hippocampiques manifestent un état d’anxiété plus prononcé que les souris témoins. En revanche une extinction de l’expression de Rnd2 dans les neurones du GD générés chez des souriceaux a très peu d’impact sur leur développement et ne perturbe pas les comportements associés à l’anxiété.
L’ensemble de ces résultats montrent donc que Rnd2 est non seulement un acteur crucial au cours de la neurogénèse adulte mais aussi un lien moléculaire entre neurogénèse adulte hippocampique et anxiété. Par ailleurs ces données sont en accord avec le concept selon lequel la neurogenèse chez l’animal adulte n’est pas une simple continuation des processus neurogéniques mis en place au cours du développement mais constitue un processus singulier qui nécessite d’être mieux caractérisé.
Référence :
The atypical Rho GTPase Rnd2 is critical for dentate granule neuron development and anxiety-like behavior during adult but not neonatal neurogenesis. Kerloch T, Farrugia F, Bouit L, Maître M, Terral G, Koehl M, Mortessagne P, Heng JI, Blanchard M, Doat H, Leste-Lasserre T, Goron A, Gonzales D, Perrais D, Guillemot F, Abrous DN, Pacary E. Mol Psychiatry. 2021 Sep 24. doi: 10.1038/s41380-021-01301-z. Online ahead of print. PMID: 34561615.
Contact :
Emilie Pacary, CR INSERM
Université de Bordeaux, INSERM U1215, Neurocentre Magendie, Bordeaux
Les avantages de publier dans le European Journal of Neuroscience (EJN)

Savez-vous qu’en tant que membre de la Société des Neurosciences, vous êtes également membre de la FENS (Federation of European Neuroscience Societies), et bénéficiez, entre autres avantages, d’un accès gratuit à son journal EJN ? Cela signifie que vous avez accès à tous les articles publiés dans EJN via notre site web, celui de la FENS ou son application.
EJN publie des articles de recherche et des comptes rendus originaux de haute qualité dans tous les domaines des neurosciences, sans frais de soumission ou de mise en page.
Le Comité de Rédaction d’EJN s’efforce d’offrir à ses auteur·e·s la meilleure expérience de publication possible, de la soumission à la diffusion.
Plus précisément :
- EJN adhère à la science ouverte et vous offre la meilleure expérience de publication pour vos recherches : option de publication en libre accès (selon accords passés avec certains pays), données partagées, rapports enregistrés et évaluation transparente par les pairs.
- EJN aide les auteur·e·s en proposant un processus de soumission rapide et facile : aucune exigence de formatage pour les soumissions et votre article sera publié en ligne dans la semaine suivant son acceptation.
- EJN est fier d’offrir un examen par les pairs constructif, équitable et attentionné, comme en témoigne la correspondance transparente de l’examen par les pairs en ligne sur Publons. Les rédacteurs de l’EJN (rédacteurs de section, rédacteurs principaux et rédacteur en chef d’EJN) examineront tous votre article et vous aideront à donner le meilleur impact à votre recherche.
- EJN garantit la visibilité de vos recherches : les articles sont téléchargés près d’un million de fois par an et continuent à être cités des années après leur publication.
- EJN soutient les autres chercheurs·euses : en publiant dans la revue de la FENS, vous contribuez à soutenir ses activités, notamment les formations et les écoles, les soutiens et différents prix, les colloques et les actions de sensibilisation.
Le Comité de Rédaction de l’EJN se réjouit de recevoir vos soumissions et se tient à votre disposition pour répondre à toutes vos questions.
