Contrôler l’activité des mGluR avec des nanobodies par Contributeur 16.01.2018 à 08h23
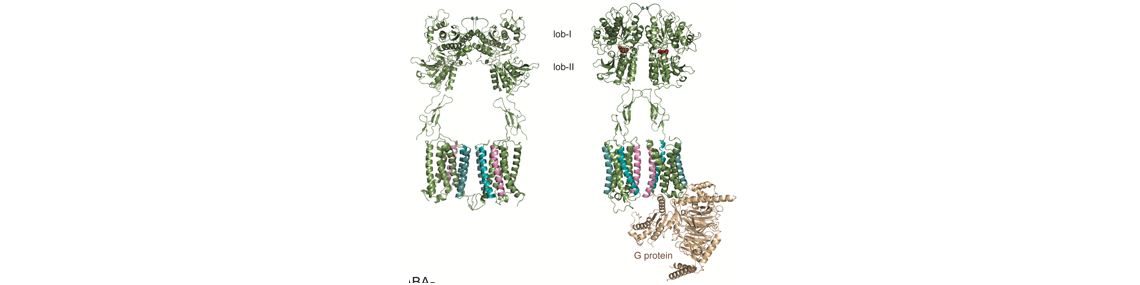
Le neurotransmetteur de la grande majorité des synapses excitatrices, le glutamate, exerce aussi des rôles modulateurs via l’activation de récepteurs couplés aux protéines G, aussi appelés les récepteurs métabotropiques du glutamate (mGluR). Ces récepteurs sont des dimères constitutifs. Huit gènes codent pour les sous-unités des mGluR, et nous avons récemment montré que ces huit sous-unités peuvent former des hétérodimères de composition définie, augmentant ainsi le nombre possible de récepteurs de huit (homodimères) à 24 (en incluant les hétérodimères possibles). Parmi ces récepteurs, ceux contenant la sous-unité mGlu2 constituent des cibles intéressantes pour le traitement de l’anxiété ou de la schizophrénie. Ainsi, de nombreuses entreprises pharmaceutiques ont développé des agonistes et des modulateurs allostériques positifs de mGlu2. Cependant, ces composés ont échoué dans les essais cliniques de phase 3 en raison d’effets secondaires ou de manque d’efficacité, qui pourraient être dus aux actions “off-target” de ces composés ou à l’existence de mGlu hétérodimériques. Dans cette étude impliquant 5 équipes françaises, dont deux de l’IGF (Pin/Rondard et Valjent) nous décrivons des nanobodies (des anticorps simple chaîne de lamas) qui agissent spécifiquement sur les homodimères mGlu2, comme des modulateurs allostériques positifs (ils augmentent les effets d’un agoniste). Ces nanobodies sont donc les premiers composés sélectifs des récepteurs mGlu2 homodimériques. Nous montrons qu’après injection dans le cerveau, l’un d’eux inhibe la consolidation de la mémoire de peur, processus dans lequel le récepteur mGlu2 homodimérique est impliqué. Cette étude montre le potentiel des nanobodies comme outils pharmacologiques mais aussi comme agents thérapeutiques potentiels pour contrôler l’activité des récepteurs dans le cerveau.
The transmitter of most excitatory synapses in the brain, glutamate, also has modulatory role through the activation of G protein-coupled receptors, the so-called metabotropic glutamate receptors (mGluRs). The mGlu receptors are mandatory dimers. Eight genes encode mGlu subunits, and we recently reported that they can assemble into heterodimers, increasing the number of possible mGlu receptors from 8 homodimers, to 24 different subtypes including the possible heterodimers. These receptors are considered as possible new targets for the treatment of various brain diseases. Among them, mGlu2 containing receptors are of interest for the treatment of anxiety and schizophrenia. As such most pharmaceutical companies developed mGlu2 receptor agonists and positive allosteric modulators, but all failed in clinical trials, mostly due to side effects or lack of efficacy. This may be partly due to the off- target effect of allosteric modulators, or the existence of mGlu2 heterodimers. In the present study, involving five research groups in France including two from the IGF (Pin/Rondard and Valjent), we identified nanobodies (single chain antibodies from lamas) specifically acting at mGlu2 homodimers, with positive allosteric properties (they enhance the action of agonist). These nanobodies are then the first highly selective positive modulators of mGlu2 homodimers. We show that injected into the brain, these nanobodies inhibit the consolidation of fear memory, implicating hippocampal mGlu2 homodimers in this process. This study reveals the great potential of nanobodies as pharmacological tools and possibly as therapeutic agents for controlling brain receptors.
Référence: Scholler P, Nevoltris D, de Bundel D, Bossi S, Moreno-Delgado D, Rovira X, Møller TC, El Moustaine D, Mathieu M, Blanc E, McLean H, Dupuis E, Mathis G, Trinquet E, Daniel H, Valjent E, Baty D, Chames P, Rondard P, Pin JP. Allosteric nanobodies uncover a role of hippocampal mGlu2 receptor homodimers in contextual fear consolidation. Nat Commun. 2017 Dec 6;8(1):1967. doi: 10.1038/s41467-017-01489-1.
Link: http://rdcu.be/AyD2
Contact chercheurs :
Institut de Génomique Fonctionnelle, CNRS, INSERM, Univ. Montpellier, F-34094, Montpellier, France.
jean-philippe.pin@igf.cnrs.fr
Philippe.Rondard@igf.cnrs.fr