Divers
Contrecarrer l’obésité : la voie prometteuse du récepteur hypothalamique TGR5 aux acides biliaires

L’obésité et ses maladies associées, telles que le diabète de type 2, sont un problème de santé majeur. A l’heure actuelle, les thérapies efficaces et durables pour le traitement de l’obésité impliquent la chirurgie plutôt que des interventions comportementales ou pharmacologiques. Les patients qui subissent une chirurgie bariatrique non seulement perdent du poids, mais présentent également une rapide rémission du diabète. Les mécanismes qui conduisent à ces changements métaboliques bénéfiques restent largement inconnus et font l’objet d’intenses recherches. Toutefois, malgré son efficacité, la chirurgie n’est pas une option thérapeutique adaptée pour de nombreux sujets obèses. Ainsi, la compréhension des mécanismes biologiques responsables de la perte de poids et des améliorations métaboliques induits par la chirurgie est cruciale pour que les voies affectées puissent être ciblées de manière moins invasive et plus spécifique.
Les acides biliaires sont aujourd’hui reconnus comme l’un des principaux acteurs des bénéfices de la chirurgie bariatrique. Ces sont des molécules synthétisées dans le foie à partir du cholestérol et qui participent à la digestion des lipides après un repas. Une certaine quantité d’acides biliaires circule aussi dans le sang. Ces molécules peuvent alors activer des récepteurs spécifiques dit TGR5 qui sont exprimés par les organes périphériques et par exemple augmenter la dépense énergétique en agissant directement au niveau du tissu adipeux, facilitant la perte de poids.
Au-delà de cette action au niveau des organes périphériques, notre étude montre que les acides biliaires circulants peuvent aussi atteindre l’hypothalamus, une structure du cerveau qui joue un rôle clé dans la régulation du poids et du métabolisme de l’organisme entier. Cette structure cérébrale exprime elle aussi des récepteurs TGR5. Chez des souris rendues obèses, le système de détection hypothalamique des acides biliaires par TGR5 est défectueux et l’activation pharmacologique des récepteurs TGR5 cérébraux amène à une diminution du poids et de la masse grasse. Ces bénéfices sont obtenus grâce à une augmentation de l’activité du système nerveux sympathique qui accroit la dépense énergétique. Au contraire, l’inhibition de l’expression et de l’activité des récepteurs TGR5 dans des neurones de l’hypothalamus facilite le développement et la progression de l’obésité. Ainsi, le système hypothalamique de détection des acides biliaires par TGR5 nous protège de l’obésité.
Référence :
Hypothalamic bile acid-TGR5 signaling protects from obesity. Castellanos-Jankiewicz A, Guzmán-Quevedo O, Fénelon VS, Zizzari P, Quarta C, Bellocchio L, Tailleux A, Charton J, Fernandois D, Henricsson M, Piveteau C, Simon V, Allard C, Quemener S, Guinot V, Hennuyer N, Perino A, Duveau A, Maitre M, Leste-Lasserre T, Clark S, Dupuy N, Cannich A, Gonzales D, Deprez B, Mithieux G, Dombrowicz D, Bäckhed F, Prevot V, Marsicano G, Staels B, Schoonjans K, Cota D. Cell Metabolism. 2021 Apr 19:S1550-4131(21)00175-3. doi: 10.1016/j.cmet.2021.04.009.
Contact chercheuse :
Daniela Cota, daniela.cota@inserm.fr, Université de Bordeaux, INSERM U1215, Neurocentre Magendie, Bordeaux
Place aux jeunes axones ; Orion appelle les cellules gliales.

Le remodelage des neurones est un mécanisme fondamental nécessaire à la précision des connexion nerveuses et in fine à la fonction du système nerveux. Ce remodelage est conservé au cours du développement, des invertébrés aux mammifères. Un élagage aberrant peut induire, chez l’adulte, des maladies neurodégénératives. Chez la mouche drosophile, le centre de la mémoire ou corps pédonculés (CP) subit, à la métamorphose, un remodelage neuronal particulièrement visible par l’élagage de certains axones. Ce mécanisme est très précis car il n’intervient que sur certains neurones et que sur les portions distales de leurs axones. Cette étape d’élagage doit avoir lieu pour permettre la repousse des nouveaux axones qui vont connecter de nouvelles cibles dans le cerveau. Si cet élagage est bloqué au moment de la métamorphose, on obtient des mouches adultes qui ne peuvent plus former de mémoire à court terme.
Les astrocytes, des cellules gliales particulières, ont un rôle actif au cours du remodelage des neurones notamment en digérant les débris neuronaux. Il était déjà connu que ce processus de dégénérescence axonale des CP est dépendant de l’infiltration des astrocytes. Cependant, comment les astrocytes sont recrutés au niveau de ces axones au cours du développement du cerveau était tout à fait inconnu. A partir d’une mutagenèse chimique, et donc d’un crible sans biais préalable, les chercheurs ont isolé le gène orion impliqué dans le remodelage neuronale des CP. Le gène orion, qui n’avait jamais été décrit précédemment, est produit par les axones et est indispensable à l’infiltration des astrocytes dans les faisceaux des axones des CP. L’analyse fonctionnelle révèle que le manque de la protéine Orion entraine un défaut dans l’élimination des débris axonaux ainsi que dans l’élagage de certains axones. Le nom orion, donné au gène, est dû aux regroupements de débris brillants (marqués avec la GFP, une protéine fluorescente) qui sont observés chez les mutants et font penser à une constellation.
Orion assure sa fonction en étant sécrétée et possède certaines caractéristiques des chimiokines de mammifères. Les chimiokines sont une famille de cytokines chimiotactiques qui contrôlent la migration directionnelle des cellules. Particulièrement, au niveau du cerveau, les chimiokines sont impliquées dans la communication entre les neurones et les cellules gliales. En effet, Orion possède un motif protéique CX3C et des motifs de liaison aux glycosaminoglycanes (GAG). Le motif CX3C chez les chimiokines est impliqué dans la liaison du ligand à son récepteur, qui, dans le cas d’Orion, reste à découvrir, et l’association avec les GAG a une grande influence sur les interactions extracellulaires de la protéine. Les chimiokines sont apparues dans un ancêtre commun des vertébrés et bien que la chimiotaxie soit décrite chez les invertébrés, les chimiokines ne sont pas présentes chez la drosophile ni même chez les insectes. En conséquence, la découverte du rôle d’Orion, une « chemokine-like » impliquée dans le dialogue entre neurones et cellules gliales au cours du remodelage neuronale représente une contribution inattendue dans le domaine en ouvrant de nouvelles voies originales de recherche pouvant conduire, entre autres, à une meilleure compréhension des dégénérescences pathologiques.
L’hypothèse proposée est qu’Orion est le signal sécrété à partir des neurones qui déclenche l’infiltration des astrocytes dans les faisceaux axonaux des CP ainsi que l’engloutissement des débris axonaux par ces même astrocytes. La caractérisation des GAG ainsi que du récepteur glial se liant à Orion qui déclenchent l’activation des astrocytes sont les perspectives à court terme pour continuer cette étude.
Référence :
Axonal chemokine-like Orion induces astrocyte infiltration and engulfment during mushroom body neuronal remodeling. Ana Boulanger, Camille Thinat, Stephan Züchner, Lee G. Fradkin, Hugues Lortat-Jacob & Jean-Maurice Dura. Nature Communications volume 12, Article number: 1849 (2021)
Contact chercheur :
Ana Boulanger IR CNRS, Jean-Maurice Dura DR CNRS,
ana.boulanger@igh.cnrs.fr, jean-maurice.dura@igh.cnrs.fr
141 rue de la Cardonille
34396 Montpellier Cedex 5
Les neurones générés à l’âge adulte dans l’hippocampe sont indispensables au maintien de la mémoire lors du rappel et de sa mise à jour
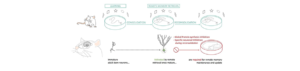
La formation de la mémoire est un processus indispensable et capital au bon fonctionnement de tout individu et se retrouve au centre de nombreuses maladies cognitives. Depuis la fin des années 90, on sait que la mémoire considérée comme stable ou consolidée peut de nouveau devenir malléable si elle est réactivée. Le processus qui suit cette réactivation a alors été appelé reconsolidation. La compréhension du processus de reconsolidation est donc capital pour la compréhension de la stabilisation de la mémoire et pour développer de nouveaux outils thérapeutiques dans la traitement des pathologiques mnésiques.
Malgré l’intérêt qui a été porté sur ce processus, la reconsolidation n’avait jamais été étudié dans le contexte de l’addition continue de nouveaux neurones dans l’hippocampe. Pourtant cette neurogénèse hippocampique confère un nouveau support à la mémoire. En effet, on sait que la neurogénèse hippocampique est importante pour l’apprentissage, la rétention de l’information, la discrimination contextuelle et même l’oubli. C’est pourquoi le rôle de la neurogénèse hippocampique sur la stabilisation de la mémoire après réactivation restait à déterminer.
Afin de démontrer le rôle des nouveaux neurones dans le processus de reconsolidation, il fallait pouvoir cibler et inhiber spécifiquement des néo-neurones qui étaient présent lors de l’apprentissage initial et qui s’étaient développés normalement jusqu’au test de rétention. Pour ce faire, nous avons développé un nouvel outil basé sur la technique de pharmacogénétique des récepteurs Dreadds. Nous avons développé un rétrovirus c’est-à-dire un virus qui ne s’exprime que dans les cellules en division et donc les nouveaux neurones, qui exprime la protéine fluorescente GFP et contient les récepteurs Dreadds. Ces récepteurs ont été mutés de telle manière à ce qu’ils ne puissent être activés que par un composé synthétique, la clozapine-N-Oxide, qui peut être facilement administré à l’animal par une simple injection intrapéritonéale. Nous avons donc utilisé cet outil pour infecter différentes populations de nouveaux neurones en fonction de leur date de naissance et en les inhibant spécifiquement lors du processus de reconsolidation.
Nous avons alors montré que les neurones de l’hippocampe qui étaient nés une semaine avant un apprentissage, c’est à dire immatures et en plein développement durant cet apprentissage étaient, lorsqu’ils atteignaient leur maturité fonctionnelle, activés lors d’un test de rétention à long terme. De plus cette population est nécessaire au maintien de la mémoire lorsque celle-ci est réactivée. Enfin elle contribue également à la mise à jour de la mémoire à long terme.
Référence:
Adult-born neurons immature during learning are necessary for remote memory reconsolidation in rats. Lods M, Pacary E, Mazier W, Farrugia F, Mortessagne P, Masachs N, Charrier V, Massa F, Cota D, Ferreira G, Abrous DN, Tronel S. Nat Commun. 2021 Mar 19;12(1):1778. doi: 10.1038/s41467-021-22069-4.
Contact chercheuse:
University of Bordeaux, INSERM U1215, Neurocentre Magendie, Bordeaux
Maladie de Huntington : l’alliance de la génomique et de l’intelligence artificielle met en avant un rôle central des pertes de résilience neuronale et une feuille de route pour les empêcher
L’équipe de recherche (Sorbonne Université/Inserm/CNRS) dirigée par Christian Néri, directeur de recherche Inserm à l’Institut de Biologie Paris-Seine en collaboration le MIT (USA), vient de montrer que la perte des mécanismes de compensation et de résilience neuronale à la maladie de Huntington serait le moteur principal de l’évolution de cette maladie au niveau moléculaire. Publiés dans eLife le 23 février 2021 et basés sur une méthode originale d’apprentissage automatique pour l’analyse précise de gros volumes de données génomiques obtenues dans des modèles de la maladie, ces travaux suggèrent que rétablir la résilience neuronale est une piste thérapeutique majeure pour une intervention précoce contre cette maladie.
Les cellules de notre corps sont naturellement capables de résister aux maladies grâce à l’homéostasie cellulaire, une série de mécanismes adaptatifs qui réparent les dommages cellulaires, impliquant des centaines de gènes qui rendent nos cellules résilientes. Bien que l’homéostasie recèle un grand potentiel de protection des neurones dans le vieillissement et les maladies neurodégénératives, l’importance et la dynamique des mécanismes homéostatiques dans les maladies neurodégénératives sont restées insaisissables en raison des difficultés d’étude de différents types de cellules dans le cerveau des mammifères.
Récemment, des technologies de criblage génomique ont été utilisées pour interroger comment les différentes cellules du cerveau utilisent des centaines de gènes pour moduler les processus neurodégénératifs. La complexité de ces données les rend cependant difficiles à analyser. En collaboration avec l’équipe de Myriam Heiman au MIT qui a obtenu ces données aux USA, l’équipe de recherche développé une approche informatique capable d’identifier précisément les groupes de gènes utilisés dans le cerveau de modèles murins pour contrer les effets toxiques de la huntingtine mutante, le gène de la maladie de Huntington (MH), au fil du temps et dans plusieurs types de neurones composant le striatum, une région du cerveau fortement affectée par la MH.
Les chercheurs ont testé si la mort neuronale dans la MH serait principalement due au renforcement des réponses pathogènes ou à la perte des réponses homéostatiques. Répondre à cette question pourrait considérablement modifier notre point de vue sur la meilleure façon de contrer la progression de la MH. Cela pourrait fournir des biomarqueurs pour savoir si une intervention thérapeutique protège le cerveau en bloquant la pathogenèse ou en augmentant l’homéostasie, améliorant ainsi la précision des études précliniques.
Pour ce faire, ils ont mis au point Geomic, une méthode d’apprentissage automatique basée sur la géométrie des données génomiques permettant d’analyser la forme (courbes, surfaces) de l’expression des gènes, et de cartographier la dynamique temporelle des réponses homéostatiques et pathogéniques. De manière inattendue, cette carte montre que la plupart des réponses pathogéniques sont atténuées avec le temps et, qui plus est, que la plupart des réponses homéostatiques diminuent. Ces résultats suggèrent que la mort neuronale dans la MH serait principalement due à la perte des réponses moléculaires homéostatiques et non au renforcement des réponses moléculaires pathogéniques, soulignant l’importance des processus homéostatiques dans l’évolution de la maladie.
Ces résultats apportent un cadre conceptuel pour explorer le développement de stratégies thérapeutiques axées sur le rétablissement des capacités de résistance des cellules cérébrales à la MH. Ils fournissent une feuille de route pour sélectionner des cibles thérapeutiques pour rétablir la résilience neuronale et des biomarqueurs pour surveiller si les médicaments émergents peuvent engager des mécanismes homéostatiques pour être efficaces, et pour utiliser ces outils dans des modèles expérimentaux de la MH. Les conclusions ouvrent la voie à des applications de Geomic à l’analyse des données ‘omiques’ dans plusieurs autres maladies, notamment d’autres maladies neurodégénératives.
Référence : Lucile Megret, Barbara Gris, Satish Sasidharan Nair, Jasmin Cevost, Mary Wertz, Jeff Aaronson, Jim Rosinski, Thomas F Vogt, Hilary Wilkinson, Myriam Heiman, Christian Neri. Shape deformation analysis reveals the temporal dynamics of cell-type-specific homeostatic and pathogenic responses to mutant huntingtin. eLife, 23 Feb 2021.
DOI: https://doi.org/10.7554/eLife.64984
Contact chercheur :
Sorbonne Université, Centre National de la Recherche Scientifique UMR 8256, INSERM ERL U1164, Paris, France
Illustration : Modélisation mathématique des réponses moléculaires dans les cellules du cerveau à partir de données génomiques obtenues dans un modèle murin de la maladie de Huntington. © Brain-C Lab
Les astrocytes, ces petites étoiles qui guident nos émotions
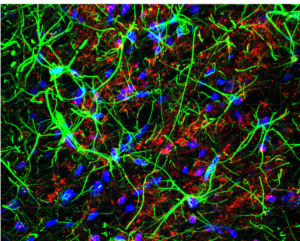
Une étude internationale vient de démontrer pour la première fois comment l’ocytocine, neuropeptide synthétisé au sein de l’hypothalamus, contrôle nos émotions. Elle est détectée par les astrocytes (astro – étoile et cyte – cellule), des cellules gliales encore peu étudiées, qui coordonnent et amplifient son action au sein du réseau neuronal pour diminuer l’anxiété et promouvoir notre bien-être. Ces importants résultats sont détaillés dans un article publié dans la revue Nature Neuroscience.
Le cerveau est composé de centaines de milliards de cellules, notamment des neurones qui ont été au centre de l’attention de la recherche et de la médecine, jusqu’à faire baptiser la science du système nerveux « neuroscience ». Cet enthousiasme vient du fait que les neurones ont la particularité d’avoir une activité électrique, attisant les espoirs des neuroscientifiques cherchant à décrypter le code neuronal dans le but de comprendre nos comportements les plus complexes. Si cette approche a connu des succès phénoménaux au cours de ces dernières décennies, il faut noter que le cerveau possède autant de neurones que de cellules gliales. Bien qu’initialement considérées comme de simples soutiens aux neurones, on assiste actuellement à un changement de paradigme : les cellules gliales, et plus particulièrement les astrocytes, collaborent étroitement avec les neurones pour traiter l’information sensorielle et émotionnelle. Ainsi, des substances neuroactives peuvent être détectées par les astrocytes, c’est le cas pour les neurotransmetteurs “classiques”, tels le glutamate ou l’adrénaline. Cependant, la participation des astrocytes dans la modulation des émotions par des neurohormones, telle que l’ocytocine, reste drapée de mystère. Récemment, une étude parue dans Nature Neuroscience a mis en évidence que les astrocytes peuvent détecter la présence de l’ocytocine. Ce petit peptide de 9 acides aminés a fait déjà couler beaucoup d’encre pour ses fonctions dans la régulation des émotions comme la douleur (Eliava et al., Neuron, 2016), la peur (Hasan et al., Neuron, 2019) ou le lien social (Tang et al., Nat Neuro, 2020), promouvant le bien-être de manière générale. Jusqu’alors, les scientifiques pensaient que les effets de l’ocytocine étaient uniquement médiés par son action directe sur les neurones. En étudiant son effet au sein de l’amygdale, une structure du système limbique, Wahis et al. ont découverts que l’ocytocine stimule une sous-population spécifique d’astrocytes, qui sécrète ensuite un messager augmentant l’activité des neurones, provoquant ainsi une diminution de l’anxiété et une sensation de bien-être chez le rongeur.
En plus d’identifier un nouvel acteur dans la signalisation de l’ocytocine au sein du cerveau, cette découverte étaye la théorie selon laquelle les neurones et les astrocytes seraient des canaux de communication complémentaires : les influx électriques portés par les neurones sont rapides et localisés tandis que les signaux astrocytaires sont longs et diffus, expliquant ce sentiment persistant de bien-être induit par l’ocytocine
Pour en savoir plus : Wahis J*, Baudon A*, Althammer F*, Kerspern D*, Goyon S, Hagiwara D, Lefèvre A, Barteczko L, Boury-Jamot B, Bellanger B, Abatis M, Silva da Gouveia M, Benusiglio D, Eliava M, Rozov A, Weinsanto I, Knobloch-Bollmann HS, Kirchner MK, Roy RJ, Wang H, Pertin M, Inquimbert P, Pitzer C, Siemens J, Goumon Y, Boutrel B, Lamy CM, Décosterd I, Chatton J-Y, Rouach N, Young SW, Stern JE, Poisbeau P, Stoop R, Darbon P, Grinevich V, Charlet A. Astrocytes mediate the effect of oxytocin in the central amygdala on neuronal activity and affective states in rodents. (Nature Neuroscience, in press). *Co-first authors.
Contact chercheur : Charlet Alexandre, acharlet@unistra.fr, Institut des Neurosciences Cellulaires et Intégratives, CNRS UPR3212, 8, allée du Général Rouvillois, 67000 Strasbourg
Altérations très précoces des régulations épigénétiques dans la maladie de Huntington

La maladie de Huntington affecte de façon primaire les neurones du striatum, structure cérébrale impliquée dans le contrôle des mouvements volontaires et dans certaines fonctions cognitives. Dans cette étude parue dans la revue Nature Communications, les scientifiques montrent que, chez des souris modèles de la maladie, les mécanismes épigénétiques qui contribuent à l’intégrité des neurones du striatum sont altérés bien avant l’apparition des troubles moteurs. Ces nouvelles données apportent une preuve moléculaire de la détérioration précoce et progressive du striatum « Huntington ».
La maladie de Huntington est une maladie génétique rare, diagnostiquée généralement à l’âge adulte et entraînant la mort au terme d’une évolution de 10-15 ans. Elle se caractérise par des symptômes moteurs (des mouvements involontaires) et comportementaux typiques, résultant d’une atteinte primaire des neurones du striatum, une région sous-corticale du cerveau. Quels sont les mécanismes qui sous-tendent la mort (ou dégénérescence) des neurones striataux ? Quand ces mécanismes se mettent-il en place ? Ces questions restent encore largement ouvertes. Y apporter des réponses est essentiel, puisque le succès d’une thérapie dépend à la fois de la spécificité du traitement et de la précocité du diagnostic.
La dégénérescence des neurones du striatum chez les patients Huntington survient au terme d’une longue période de dysfonctionnement, portant atteinte à leur identité. Au cours du développement, les cellules se différencient en types cellulaires définis (par exemple, une cellule musculaire, hépatique, neuronale, etc…), acquérant ainsi une fonction et une identité précises. L’acquisition et le maintien d’une fonction/identité cellulaire au sein d’un organisme est sous le contrôle de mécanismes épigénétiques, c’est-à-dire de mécanismes capables de modifier l’état de compaction de la chromatine, et en conséquence l’accessibilité des gènes. Ainsi, certaines modifications chimiques sur les histones -un composant majeur de la chromatine- comme l’acétylation favorisent un état relâché de la chromatine, permettant l’expression des gènes. Les gènes qui définissent la fonction/l’identité d’une cellule sont fortement exprimés, et la chromatine qui les porte est régionalement hyper-acétylée.
On savait que l’expression des gènes de l’identité striatale et l’acétylation de la chromatine associée étaient réduites chez les patients Huntington et chez des souris modèles symptomatiques. Cette nouvelle étude révèle que la perte sélective d’acétylation des histones au niveau des gènes de l’identité striatale se met en place très précocement, bien avant l’apparition des déficits moteurs chez la souris, et que ce processus a pour effet une accélération des mécanismes épigénétiques liés au vieillissement.
La maladie de Huntington est causée par une mutation unique, une répétition anormale de codons CAG dans le gène Huntingtine (HTT). Les scientifiques montrent que des altérations épigénétiques ciblent plus spécifiquement le gène muté. Les résultats indiquent que la présence de la mutation chez la souris modifie précocement l’organisation tridimensionnelle de la chromatine et l’expression des gènes associés.
Ces travaux améliorent ainsi la compréhension du processus pathogénique de la maladie de Huntington, en montrant que la mutation en cause affecte précocement la chromatine du striatum par deux mécanismes distincts.
Référence: Age-related and disease locus-specific mechanisms contribute to early remodelling of chromatin structure in Huntington’s disease mice. Alcal.-Vida R, Seguin J, Lotz C, Molitor AM, Irastorza-Azcarate I, Awada A, Karasu N, Bombardier A, Cosquer B, Gomez Skarmeta JL, Cassel JC, Boutillier AL, Sexton T, Merienne K
Nature communications 13 Janvier 2021. https://doi.org/10.1038/s41467-020-20605-2
Contact chercheuse: Karine Merienne, Chercheuse CNRS au Laboratoire de neurosciences cognitives et adaptatives (LNCA). karine.merienne@unistra.fr
Modifier les macrophages à la périphérie a la capacité de changer la réactivité microgliale et de ralentir la progression de la maladie des souris SLA

La Sclérose Latérale Amyotrophique (SLA) aussi connue sous le nom de maladie de Charcot est la maladie du motoneurone la plus répandue. Des études antérieures dont celles du Dr Boillée avaient montré que les cellules dans l’environnement des motoneurones participaient à la progression de la maladie et notamment les cellules microgliales, macrophages du SNC. Cependant, ces études n’avaient pas distingué les contributions respectives des cellules microgliales et des macrophages à la périphérie. Or, les motoneurones spinaux ont leur corps cellulaire dans le SNC et sont donc entourés de cellules microgliales alors que leur axone qui s’étant à la périphérie pour se connecter aux muscles est entouré de macrophages périphériques. Sachant que les cellules microgliales ont des origines développementales différentes et sont dans des environnements distincts, l’hypothèse de l’équipe du Dr Boillée a été que les macrophages périphériques pourraient avoir un rôle particulier au cours de la dégénérescence motoneuronale.
Dans cette étude Chiot et collaborateurs ont d’abord montré que les macrophages dans les nerfs périphériques étaient progressivement activés au cours de la maladie chez les souris SLA et que des macrophages activés étaient aussi retrouvés dans les nerfs périphériques des patients SLA. Afin d’analyser le rôle des macrophages périphériques, les macrophages des souris SLA ont été remplacés par des macrophages contrôles ou plus neurotrophiques ou moins neurotoxiques, à l’aide de greffe de moelle osseuse sans remplacer les cellules microgliales. Le remplacement par les macrophages plus neurotrophiques a permis de réduire l’activation des macrophages périphériques mais aussi des cellules microgliales, de ralentir la progression de la maladie et d’augmenter la survie des souris SLA. L’analyse du transcriptome (par RNAseq) des macrophages périphériques des nerfs sciatiques de souris SLA tout au long de la maladie comparé au transcriptome des cellules microgliales a montré que ces deux types cellulaires réagissaient de manière très différente à la même atteinte des motoneurones. Les souris greffées ayant survécu plus longtemps avaient une réponse immunitaire des macrophages périphériques atténuée mais aussi une modification du transciptome microglial vers un profil de soutien neuronal.
Les macrophages périphériques et les cellules microgliales doivent donc être considérés comme deux types cellulaires distincts et les macrophages périphériques pourraient constituer une nouvelle cible thérapeutique pour la SLA, plus facile à atteindre que les cellules microgliales dans le SNC.
Source :
Chiot A, Zaïdi S, Iltis C, Ribon M, Berriat F, Schiaffino L, Jolly A, de la Grange P, Mallat M, Bohl D, Millecamps S, Seilhean D, Lobsiger CS, Boillée S. Modifying macrophages at the periphery has the capacity to change microglial reactivity and to extend ALS survival. Nat Neurosci. 2020 Nov;23(11):1339-1351. doi: 10.1038/s41593-020-00718-z
Contact chercheuse:
Séverine Boillée, Institut du Cerveau, Paris
Le double jeu de l’APP: fonction et dysfonction neuronale
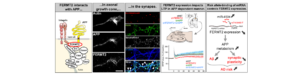
La maladie d’Alzheimer (MA) est la principale cause de démence. Elle se caractérise par l’association de deux types de lésions: (i) la dégénérescence neurofibrillaires constituées de protéines Tau hyperphosphorylées et (ii) des plaques amyloïdes extracellulaires formées d’agrégats de peptides β-amyloïdes (Aβ) résultant du clivage de la protéine précurseur de l’amyloïde (APP). L’identification de mutations dans les formes autosomiques dominantes à début précoce a placé le métabolisme anormal de l’APP au centre de la maladie, renforçant ainsi l’hypothèse de la cascade amyloïde: la surproduction de peptides Aβ – en particulier les formes plus longues que l’on pense être plus neurotoxiques – pourrait conduire à (ou favoriser) la pathologie Tau et la mort neuronale. Cependant, une grande partie des acteurs moléculaires régulant le metabolisme de l’APP n’a pas encore été caractérisée.
De façon intéressante, les études d’association à l’échelle du génome (GWAS) ont identifié un grand nombre de gènes augmentant le risque de développer les formes les plus courantes de la MA. On peut raisonnablement supposer que certains de ces facteurs génétiques seraient impliqués dans le métabolisme de l’APP et la production d’Aβ. Dans ce contexte, nous avons combiné deux criblages à haut débit à l’échelle du génome pour évaluer l’impact fonctionnel des gènes et microARNR (miRNA) sur le métabolisme de l’APP. Cette approche a mis en évidence l’implication du un facteur de risque génétique FERMT2 (ou Kindlin-2), en tant que modulateur clé potentiel du guidage axonal; un processus neuronal qui dépend de la régulation du métabolisme de l’APP. Nous avons constaté que FERMT2 interagit directement avec APP pour moduler son métabolisme et que la sous-expression de FERMT2 affecte la croissance axonale, la connectivité synaptique et la potentialisation à long terme d’une manière dépendante de l’APP. Enfin, l’allèle rs7143400-T, associé à un risque accru de MA et localisé dans le 3’UTR de FERMT2, a induit une régulation à la baisse de l’expression de FERMT2 par liaison du miR-4504. Ce miARN est principalement exprimé dans les neurones et significativement surexprimé dans les cerveaux de patients par rapport aux témoins. Dans l’ensemble, nos données fournissent des arguments en faveur d’un effet déletère de la sous-expression de FERMT2 dans les neurones et un aperçu de la façon dont cela peut influencer le développement de la MA.
Reference: Alzheimer’s genetic risk factor FERMT2 (Kindlin-2) controls axonal growth and synaptic plasticity in an APP-dependent manner. Eysert F, Coulon A, Boscher E, Vreulx AC, Flaig A, Mendes T, Hughes S, Grenier-Boley B, Hanoulle X, Demiautte F, Bauer C, Marttinen M, Takalo M, Amouyel P, Desai S, Pike I, Hiltunen M, Chécler F, Farinelli M, Delay C, Malmanche N, Hébert SS, Dumont J, Kilinc D, Lambert JC, Chapuis J. Mol Psychiatry. 2020 Nov 3. doi: 10.1038/s41380-020-00926-w. Online ahead of print. PMID: 33144711
Contact chercheur: Julien Chapuis, PhD
Unité INSERM-1167, « Facteurs de risque et déterminants moléculaires des maladies liées au vieillissement », Lille.
Alzheimer’s disease (AD) is the principal cause of dementia. AD is characterized by two main pathological hallmarks: (i) intracellular neurofibrillary tangles consisting of hyper-phosphorylated Tau proteins and (ii) extracellular amyloid plaques consisting of aggregates of β-amyloid (Aβ) peptides resulting from the processing of amyloid precursor protein (APP). The identification of early-onset autosomal dominant AD-linked mutations have placed abnormal APP metabolism at the center of the disease, further supporting the amyloid cascade hypothesis: the overproduction of Aβ peptides –especially the longer forms that are thought to be more neurotoxic– may lead to (or favor) Tau pathology and subsequent neuronal death. However, a large proportion of the key molecular players in APP trafficking have yet to been characterized.
Interestingly, Genome-Wide Association Studies (GWASs) identify a large number of novel risk-increasing loci in common late-onset form of AD. One can reasonably assume that some of these genetic factors are involved in APP metabolism and Aβ production. In this context, we combined two genome-wide high-content screenings to assess the functional impact of miRNAs and genes on APP metabolism. This approach highlighted the involvement of FERMT2 (or Kindlin-2), a genetic risk factor of AD, as a potential key modulator of axon guidance; a neuronal process that depends on the regulation of APP metabolism. We found that FERMT2 directly interacts with APP to modulate its metabolism and that FERMT2 under-expression impacts axonal growth, synaptic connectivity and long-term potentiation in an APP-dependent manner. Lastly, the rs7143400-T allele, which is associated with an increased AD risk and localized within the 3’UTR of FERMT2, induced a down-regulation of FERMT2 expression through binding of miR-4504 among others. This miRNA is mainly expressed in neurons and significantly overexpressed in AD brains compared to controls. Altogether, our data provide strong evidence for a detrimental effect of FERMT2 under-expression in neurons and insight on how this may influence AD pathogenesis.
Maladie de Huntington: des anomalies cérébrales détectables dès le stade embryonnaire chez l’homme
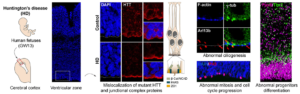
La maladie de Huntington – comme la maladie d’Alzheimer, de Parkinson et la sclérose latérale amyotrophique- fait partie de la famille des maladies qui se manifestent à l’âge adulte alors que -en ce qui concerne les formes héréditaires- l’anomalie génétique est présente dès la conception. Par exemple, la protéine huntingtine (HTT) dont la mutation du gène par expansion de triplets CAG conduit à la maladie, est exprimée très précocement dans le développement pendant lequel elle joue un rôle essentiel. La HTT mutante interfère avec plusieurs étapes du développement de certaines régions cérébrales, dont le cortex. De plus, l’expression de la HTT mutante restreinte au développement suffit à produire des caractéristiques de la maladie de Huntington chez des souris adultes suggérant qu’il y a une composante développementale à la maladie.
Savoir si le développement cérébral humain précoce est modifié restait une question centrale dans le domaine. Pour y répondre, les équipes de Sandrine Humbert, directrice de recherche Inserm au Grenoble Institut des neurosciences (Inserm/Université Grenoble Alpes), et Alexandra Durr, professeur des universités-praticien hospitalier à Sorbonne Université, à l’Hôpital de la Pitié Salpêtrière – AP-HP et à l’Institut du cerveau (Inserm/Sorbonne Université/CNRS/AP-HP) ont examiné des tissus de fœtus humains porteurs de l’expansion pathologique de triplet CAG dans le gène HTT, issus de dons des parents suite à une interruption médicale de grossesse. Ces tissus présentent des anomalies dans le cortex en développement, notamment une mauvaise localisation de la huntingtine mutante et de protéines de complexes de jonction, des défauts de polarité et de différenciation des précurseurs neuronaux, une ciliogénèse anormale et des changements dans la mitose et la progression du cycle cellulaire. Ces anomalies perturbent l’équilibre « division-différentiation » des cellules progénitrices. Celles-ci sont en effet issues d’un réservoir de cellules en division dont une partie se différencie en neurones tandis que l’autre continue de se diviser pour fournir de nouvelles cellules progénitrices. Chez les embryons porteurs de la mutation, ces cellules progénitrices entrent plus vite en différenciation au dépend du réservoir de cellules en division.
Ces travaux fournissent donc la première preuve directe provenant de fœtus humains que le développement du cerveau est altéré dans une maladie neurodégénérative se manifestant à l’âge adulte. Cette découverte ouvre un champ de nouvelles investigations visant à comprendre comment ces défauts précoces contribuent à la pathologie adulte et comment la compensation de ces derniers est régulée. Cette découverte a aussi des conséquences importantes pour la façon et le stade auxquels les traitements qui modifient le cours de la maladie doivent être envisagés.
Reference
Huntington disease alters human neurodevelopment. M Barnat, M Capizzi, E Aparicio, S Boluda, D Wennagel, R Kacher, R Kassem, S Lenoir, F Agasse, BY Braz, JP Liu, J Ighil, A Tessier, SO Zeitlin, C Duyckaerts, M Dommergues, A Durr, S Humbert. Science, 2020, 10.1126/science.aax3338
Contact chercheuses
Univ.Grenoble Alpes, INSERM,U1216, Grenoble Institut Neurosciences, Grenoble, France
Institut du Cerveau et de la MoelleEpinière (ICM), Genetics, AP HP, Sorbonne University, InsermU1127, CNRSUMR7225, Pitié-Salpêtrière Hospital, Paris, France.
Huntington disease alters human neurodevelopment
Huntington disease – like amyotrophic lateral sclerosis and Alzheimer’s and Parkinson’s disease – is part of the family of diseases that shared a delayed onset in mid-adulthood despite the expression, at least in hereditary cases, of the disease-driving protein from the first days of life. For example, huntingtin, the protein mutated in Huntington disease, is expressed very early in development during which it plays a key role. In mice, mutant huntingtin interferes with several stages of development in certain brain regions, including the cortex. Furthermore, expression of mutant huntingtin restricted to development is sufficient to produce features of Huntington’s disease in adult mice suggesting that there is a developmental component to the disease.
Nevertheless, whether early human brain development is altered remained a central question in the field. To answer it, teams led Sandrine Humbert, research director, INSERM (the French National Institute for Health and Medical Research) and group leader at the Grenoble Institut des Neurosciences, and by Alexandra Durr, professor at Sorbonne University and team leader in the Paris Brain Institute at Pitie-Salpêtrière Hospital, Paris had access to fetal tissue from families that terminated their pregnancy in the context of a prenatal test. The developing fetus carried the Huntington disease gene mutation. These tissues showed abnormalities in the developing cortex, including abnormal localization of mutant huntingtin and junction complex proteins, defects in polarity and differentiation of neural precursors, abnormal ciliogenesis, and changes in mitosis and cell cycle progression. These abnormalities disrupt the « division-differentiation » balance of progenitor cells. Progenitor cells come from a pool of dividing cells, some of which differentiate into neurons while the other continues to divide to provide new progenitor cells. In Huntington disease gene carrier embryos, these progenitor cells differentiate more rapidly at the expense of the pool of dividing cells.
This work provides the first direct evidence from human fetuses that brain development is impaired in a neurodegenerative disease with delayed onset. This discovery opens up a field of new investigations aimed at understanding how these early defects contribute to adult pathology and how their compensation is regulated. This discovery also has important implications for the way and stage at which disease-modifying treatments should be considered.
Le contact tactile favorise les interactions sociales via l’ocytocine

Une étude internationale vient de démontrer pour la première fois que par quel biais l’ocytocine, neuropeptide synthétisé au sein de l’hypothalamus, facilite les interactions sociales : un contact physique active des neurones parvocellulaires de l’hypothalamus, qui coordonnent la sécrétion d’ocytocine pour promouvoir les comportements prosociaux. Ces importants résultats sont détaillés dans un article publié dans la revue Nature Neuroscience.
De la plus douce caresse au coup le plus violent, le toucher est au cœur de notre expérience sensorielle et façonne notre manière de percevoir le monde, particulièrement lors d’interactions intimes avec d’autres êtres humains. Pourtant, bien que le sens du toucher soit au centre de notre perception, cette modalité a toujours été éclipsée par la vision ou l’audition dans la philosophie, la recherche scientifique et la psychologie. Au cours de l’évolution, les vertébrés ont développé une pléthore de systèmes sensoriels sophistiqués, qui représentent un avantage évolutif certain et impliquent la capacité de discriminer les différentes formes de contacts selon qu’ils soient nociceptifs ou non, désagréables ou agréables. Le contact social est un prérequis pour l’intimité, d’une importance primordiale pour la formation de relations de confiance, et ainsi, plusieurs formes de touchers, de toilettages et de caresses ont pu être observés chez les rongeurs, les félins ou encore les primates.
L’établissement et la maintenance de hiérarchies sociales sont modulés par diverses molécules dans le cerveau. Durant la dernière décennie, l’une d’entre elle a émergé comme actrice majeure : le neuropeptide ocytocine. L’ocytocine, en plus de permettre l’accouchement et la lactation, modifie le fonctionnement du cerveau pour réguler les émotions, les relations sexuelles ainsi que l’attachement amoureux ou les comportements parentaux. Cependant, les aspects mécanistiques par lesquels l’ocytocine favorise ces comportements prosociaux, et ce qui déclenche la libération de ce neuropeptide sont encore des questions en suspens.
Dans une récente étude, dont les résultats viennent d’être publiés dans la revue Nature Neuroscience (Tang et al., 2020), l’équipe internationale animée et coordonnée par les Drs. Alexandre Charlet (France) et Valery Grinevich (Allemagne) révèle qu’une petite population de neurones à ocytocine, dénommée parvocellulaires, du fait de leur petite taille, sont responsables de la traduction des signaux sensoriels physiques en diverses formes de comportements sociaux.
Pour ce faire, ils ont enregistré les neurones synthétisant l’ocytocine chez des rats femelles se déplaçant librement et interagissant avec une congénère. Leurs analyses montrent que les neurones à ocytocines sont particulièrement actifs lors d’un contact tactile entre deux animaux. Les auteurs ont utilisé de nombreuses techniques complémentaires, de l’imagerie calcique à l’évaluation comportementale, en passant par la manipulation optogénétique de neurones spécifiques, pour montrer que l’activation de ces neurones induit l’excitation d’une population de neurones ocytocinergiques bien plus grande, ce qui favorise alors l’interaction entre femelles. Ces découvertes fournissent des notions fondamentalement nouvelles sur la manière dont ce neuropeptide orchestre les comportements sociaux. De plus, les résultats obtenus dans ce travail supportent une vision de l’ocytocine comme un puissant agent pour traiter certains troubles psychiatriques : une combinaison de stimulus tactiles (par exemple un massage) et une administration d’ocytocine intra nasale pourraient atténuer les altérations socio-émotionnelles chez les patients atteints de maladies mentales, comme l’autisme ou bien le trouble de stress posttraumatique.
Pour en savoir plus :
Tang Y*, Benusiglio D*, Lefevre A*, Hilfiger L*, Althammer F, Bludau A, Hagiwara D, Baudon A, Darbon P, Schimmer J, Kirchner MK, Roy RK, Wang S, Eliava M, Wagner S, Oberhuber M, Conzelmann KK, Schwarz M, Stern JE, Leng G, Neumann ID, Charlet A#, Grinevich V#. Social touch promotes interfemale communication via activation of parvocellular oxytocin neurons. Nat Neurosci. 2020 Jul 27. doi: 10.1038/s41593-020-0674-y.
#Corresponding and Co-senior authors; *Co-first authors.
Contact chercheur :
Alexandre Charlet, CRCN CNRS,
Institut des Neurosciences Cellulaires et Intégratives, CNRS UPR3212, Strasbourg
© Illustration A. Charlet & V. Grinevich