Participation de mécanismes épigénétiques au déficit mnésique associé à la maladie de Huntington par Contributeur 27.02.2023 à 02h22
La maladie de Huntington (MH) est une maladie neurodégénérative héréditaire qui débute le plus souvent à l’âge adulte et entraîne la mort après 10 à 15 ans d’évolution. C’est une maladie qui affecte de façon primaire le striatum, une structure cérébrale impliquée dans le contrôle des mouvements volontaires, mais aussi dans certaines fonctions cognitives/psychiatriques, notamment la mémoire des habitudes (par exemple faire du vélo, conduire…), la flexibilité comportementale, la motivation…. Dans la MH, les symptômes cognitifs, qui précèdent généralement les atteintes motrices d’une dizaine d’années, ont un impact majeur sur la qualité de vie des patients. Pour autant, la prise en charge médicale de ces symptômes se limite aux thérapies cognitives et/ou comportementales. Le développement de traitements plus ciblés est entravé par la méconnaissance des mécanismes moléculaires et cellulaires qui sous-tendent les altérations cognitives spécifiques de la MH. Cette étude effectuée à l’aide de souris modèles et de techniques « omics », permettant d’interroger l’état de la chromatine à l’échelle du génome, montre que le déficit de mémoire des habitudes, typique d’un dysfonctionnement du striatum, est associé à une diminution des régulations épigénétiques et géniques impliquées dans la formation, la consolidation et le rappel de cette mémoire. Ainsi, chez les animaux témoins, le processus mnésique s’accompagne d’un remodelage important de l’organisation spatiale de la chromatine, d’une augmentation du degré d’acétylation des histones au niveau de gènes responsables de la plasticité cérébrale, et de leur activation transcriptionnelle. Ces régulations, qui impliquent à la fois les neurones et les cellules gliales, sont fortement atténuées chez les souris modèles de la MH. L’étude permet enfin d’identifier des mécanismes et cibles nouvelles, notamment l’acétylation de la lysine 9 de l’histone H3 et la voie de signalisation TGF beta, qui pourraient être un point de départ au développement de stratégies thérapeutiques innovantes.
Référence :
Altered activity-regulated H3K9 acetylation at TGF-beta signaling genes during egocentric memory in Huntington’s disease. Alcalá-Vida R, Lotz C, Brulé B, Seguin J, Decraene C, Awada A, Bombardier A, Cosquer B, Pereira de Vasconcelos A, Brouillet E, Cassel JC, Boutillier AL, Merienne K. Prog Neurobiol. 2022 Dec;219:102363.
Légende de l’illustration :
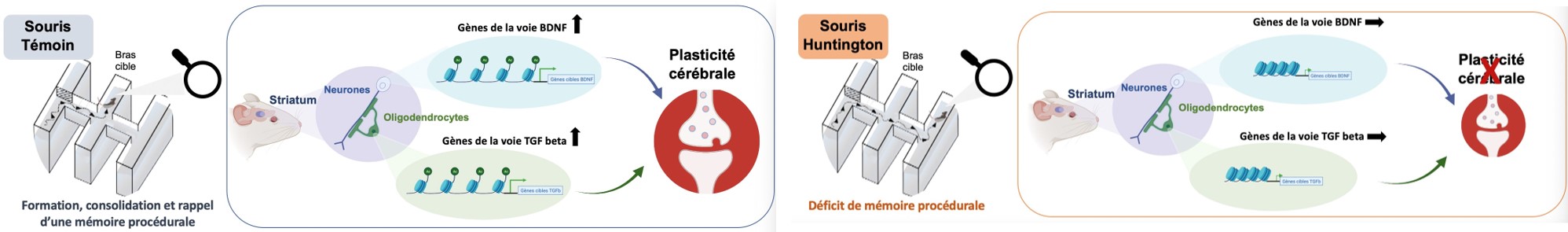
Chez les souris témoins, la formation, la consolidation et le rappel d’une mémoire procédurale (ou mémoire des habitudes, ici apprendre au travers d’essais répétés une séquence motrice définie pour trouver une plate-forme invisible, localisée dans le bras cible) entraîne des réponses épigénétiques dans les neurones et les cellules non neuronales (e.g. les oligodendrocytes) du striatum. Ces réponses, qui mettent en jeu l’acétylation des histones, sont associées à l’activation de gènes associés aux voies de signalisation du BDNF et du TGF beta, qui sont deux voies majeures de la plasticité cellulaire. Chez les souris Huntington, le déficit de mémoire procédurale s’accompagne d’une altération de ces réponses épigénétiques essentielles à la plasticité cérébrale. Copyright : Karine Merienne et Rafael Alcala Vida ; Crée avec Biorender
Contact :
Karine Merienne, Directrice de recherche CNRS
karine.merienne@unistra.fr
Laboratoire de Neurosciences Cognitives et Adaptatives (LNCA), Université de Strasbourg, Strasbourg 67000, France
Centre National de la Recherche Scientifique (CNRS, UMR 7364), Strasbourg 67000, France
English summary:
Huntington’s disease (HD) is a genetic neurodegenerative disease, usually characterized by an adult onset, and leading to death within 10 to 15 years. The disease primarily affects the striatum, a brain structure implicated in the control of voluntary movements, and also in cognitive/psychiatric functions, including memory of habits (e.g. biking, driving…), cognitive flexibility, motivation…In HD, cognitive symptoms, which generally precede by 10 years motor alterations, have dramatic impact on patients’ quality of life. Medical care of those symptoms only relies on cognitive/behavioral therapies. The molecular and cellular mechanisms underlying cognitive symptoms in HD remain elusive, which limits the development of specific treatments targeting those symptoms. This study, using “omics” approaches to interrogate the chromatin status at genome-wide level, shows that the deficit in habit memory in HD mouse model associates with reduction of epigenetic gene regulations implicated in the formation, consolidation and recall of this memory. In control animals, memory processing is accompanied by major remodeling of spatial organization of the chromatin, increased histone acetylation at genes driving brain plasticity, together with their transcriptional activation. Those regulations, which implicate both neurons and glial cells, are strongly reduced in HD mice. The study also points to new mechanisms and targets, particularly acetylation of histone H3 lysine 9 and TGF beta signaling pathway, which might offer innovative leads to improve HD.